Современные подходы к диагностике и лечению реактивных артритов
Острые артриты имеют несколько причин [1]. Нужно дифференцировать реактивный и септический артриты; последние следует подозревать, когда у пациента развивается острый болезненный моноартрит с системными и местными признаками воспаления [2]. В случае гнойного бактериального артрита, который является наиболее частой формой септического артрита, типичными клиническими проявлениями являются острое начало и очень болезненный моноартрит с лихорадкой [2, 3].
С другой стороны, «реактивный артрит» следует подозревать при наличии воспаления и болей в суставах одновременно нескольких локализаций. В том числе могут наблюдаться боли и другие признаки воспаления в области позвоночника, мелких суставов кистей рук и стоп в сочетании с внесуставными симптомами, возникающими после перенесенной инфекции пищеварительной или мочеполовой системы [4], неуточненных ОРЗ вирусного и бактериального происхождения [5].
Однако, когда появляются симптомы реактивного артрита при бактериологическом исследовании суставной жидкости, как правило, роста бактерий не выявляется. К сожалению, у врачей редко есть возможность исследовать синовиальную жидкость на наличие внутриклеточных инфекций и вирусов и в таком случае антиген, вызвавший воспаление, не обнаруживается, в том числе и потому что суставные симптомы появляются после исчезновения острых признаков инфекции [3].
Некоторые формы реактивного артрита называют синдромом Рейтера, они характеризуется известной классической триадой: артрит крупных суставов, уретрит у мужчин, цервицит у женщин, а также воспаление глаз (в основном конъюнктивит или увеит) [6]. В зависимости от инфекции, у пациентов могут также развиться другие симптомы, в основном поражающие кожу, слизистые, желудочно-кишечный тракт [7].
Характерным для развития реактивного артрита является поражение до пяти крупных суставов и аддитивное или миграционное течение. В первом случае различные суставы постепенно воспаляются без исчезновения симптомов в ранних локализациях, в то время как во втором случае новые очаги артрита появляются после стухания воспаления в предыдущих местах поражения [8].
Эпидемиология заболевания
Реактивный артрит чаще всего поражает молодых людей в возрасте от 20 до 40 лет. Интересно, что люди со светлой кожей чаще подвержены заболеванию, возможно, из-за более высокой частоты аллеля HLA-B27 в этой этнической группе. Известно, что аллели HLA-B51 и HLA-DRB1 также связаны с реактивным артритом; существуют данные о повышенной восприимчивости у лиц с генотипом HLA-C1C1 [9], что указывает на отсутствие лигандов HLA для иммуноглобулиноподобного рецептора (KIR) KIR2DL1 [10], ингибирующего клетки-киллеры. Дисбаланс между активирующими и ингибирующими сигналами KIR может позволить патогенам вызывать перепроизводство цитокинов. Этот тип артрита реже встречается у детей и обычно вызывается желудочно-кишечными инфекциями и после перенесения неуточненных ОРЗ [11]. Реактивный артрит в равной степени встречается у обоих полов, случаи, вызванные Chlamydia trachomatis, чаще встречаются у мужчин. Сообщается, что годовая частота реактивного артрита колеблется от 1 до 30 случаев/100000 в зависимости от частоты антигенов в конкретной области [11, 12].
Этиопатогенез
Реактивный артрит проявляется примерно через 1–3 недели после острой или обострившейся инфекции, но механизмы взаимодействия между микробным антигеном и хозяином до конца не изучены [2]. В отличие от септического артрита, культуры синовиальной жидкости стерильны, что подтверждает факт того, что реактивный артрит вызван чрезмерно стимулированным аутоиммунным ответом на фоне инфекционного воздействия. Антигенами, запускающими реактивный артрит, могут быть грамотрицательные внутриклеточные бактерии или вирусы. Сначала возбудитель проникает в слизистую оболочку желудочно-кишечной, урогенитальной или респираторной систем [1, 4]. До конца не известно, что способствует такому вторжению, но существуют факторы, препятствующие полному уничтожению возбудителей в организме, и антигенная РНК или ДНК могут быть идентифицированы в различных жидкостях организма в течение многих лет после заражения. Среди бактериологических этиологических факторов важную роль играют Chlamydia spp, Micoplasma spp, Ureoplasma ureolitica. Вирусы, являющиеся причиной развития реактивных артритов: Герпес 1/2, Эпштейн Барра вирус (EBV), цитомегаловирус (CMV), варицелла зостер вирус (VZV), герпес 6 типа (HH 6), Коксаки, Эховирус, Парвовирус B19, вирус гепатита B и С, Альфавирусы, HTLV-1 [4,12].
Важными и наиболее распространенными этиологическими факторами в нашем регионе являются вирусы группы герпеса. Они могут проявляться в популяции всех возрастных групп и при определенных условиях длительно находиться в состоянии персистирующего острого воспаления. Внутриклеточные инфекции вызывают иммунный ответ, характеризующийся изменением в соотношении CD4/8, приводящий к развитию артрита [7]. Измененный иммунный ответ приводит к несбалансированному продуцированию цитокинов Th2, что также способствует плохой элиминации антигенов [9, 10]. Присутствие гена HLA-B27, по-видимому, связано не с возникновением реактивного артрита, а с его сохранением в хронической форме, и одна из гипотез состоит в том, что этот гаплотип способствует перекрестной реакции между антигеном и хозяином или сам может быть целью иммунной агрессии [10, 13]. Тем не менее, генетическая восприимчивость существует, поскольку только у 1–15 % инфицированных развивается реактивный артрит [10].
Диагностические критерии
Для реактивного артрита не существует четких диагностических или классификационных критериев [1, 4]. Соответственно, определение реактивного артрита должно основываться на исследовании синовиальной жидкости или ткани, хотя в клинической практике могут возникнуть проблемы с получением данных образцов для иммуногистохимии, ПЦР или РИФ. Помимо клинической картины лабораторные исследования имеют основополагающее значение для определения пусковой инфекции, путем выделения микроба или повышенных титров антител. Диагноз представляет собой сочетание лабораторных и клинических данных [2, 7].
При кишечной инфекции возможно выделение микробов из испражнений во время острой фазы, но более эффективный способ обнаружить антиген – это сывороточные антитела. Генитальные инфекции трудно определить, так как они часто протекают бессимптомно, но при подозрении на их присутствие следует проводить исследование с помощью ПЦР или РИФ. То же характерно для Сhlamydia и Micoplasma pneumonia, паразитирующих на слизистых дыхательных путей [3]. Серологическое определение антител к хламидиям, микоплазмам и уреоплазмам имеет ограниченное применение из-за возможной перекрестной реактивности и высокой распространенности специфических антител в общей популяции [5, 8].
Важно рассматривать герпетическую группу как один из возможных и наиболее вероятных этиопатогенов. Их активность, обуславливающая изменения в иммунном ответе, часто является пусковым механизмом. Понимая механизм их развития, следует определять в лейкоцитарной массе их ДНК или белки, ответственные за репликацию [12].
Также характерными признаками для реактивных артритов являются повышение СОЭ, СРБ, сиаловых кистот и серомукоидов без изменений РФ и АСЛО [13].
Клинические проявления
Началу реактивного артрита часто предшествуют симптомы пусковой инфекции. Они представлены диареей в случае желудочно-кишечной инфекции, катаральными проявлениями при ОРЗ, длительной лимфоаденопатией и/или субфебрилитетом при активности герпес-вирусов и другими симптомами в соответствии с локализацией первичной инфекции: в случае урогенитальной инфекции проявляются симптомы дизурии или поллакиурии, простатит у мужчин и цервицит, сальпингит и/или вульвовагинит у женщин. Клинические симптомы реактивного артрита обычно развиваются через 1–3 недели (иногда до 6 недель) после заражения [4, 13]. Их можно подразделить на суставные и внесуставные проявления. Типичный случай реактивного артрита представлен асимметричным олигоартритом, поражающим крупные суставы нижних конечностей. В менее частых случаях артрит может поражать и верхние конечности, особенно мелкие суставы при легких формах. Около 30 % пациентов имеют острую боль в спине, которая усиливается в течение ночи [12, 14].
Экспериментальная терапия
В исследовании участвовало 88 человек (47 мужчин и 41 женщин) в возрасте от 18 до 62 лет. Длительность заболевания составляла от 7 дней до 6 месяцев. У 84,2 % пациентов отмечалось миграционное течение заболевания с вовлечением до 5–7 суставов разной локализации, у остальных было прогрессирующее аддитивное течение с воспалением 2–5 суставов. Дополнительно у 72 % пациентов с персистенцией герпес-вирусной инфекции в периоде обострения отмечался длительный субфебрилитет, лимфоаденопатия, синдром хронической усталости; 24,5 % пациентов жаловались на длительное першение в горле и другие катаральные симптомы (в 90 % случаев катаральные явления наблюдались при сочетанном обнаружении герпес-вирусов и Chlamidia и Mycoplasma рneumoniae); симптомы воспаления в мочеполовой сфере отмечались у 21,5 %. Состояние пациентов было легкой (15,5 %) и средней тяжести (84,5 %).
В большинстве случаев было сочетанное поражение вирусно-бактериальными патогенами (табл. 1), антигены обнаруживались в соскобах со слизистых (бактериальные возбудители) и при исследовании лейкоцитарной массы, в случае вирусов группы герпеса, методом РИФ. В 67,6 % случаев наблюдалось одновременное обнаружение одного или нескольких видов герпеса с бактериальным антигеном, в 26,8 % с 2-мя бактериальными возбудителями, в 5,6 % случаев герпетическая инфекция сочеталась с 3-мя и более бактериальными внутриклеточными возбудителями.
Лечение реактивного артрита состоит в адекватной терапии триггерной инфекции и артрита и/или внесуставных проявлений [17]. Для лечения бактериальных инфекций этиотропная терапия обычно основана на использовании макролидов, фторхинолонов или тетрациклинов. В данном аспекте целесообразна терапия с применением ацикловира, валцикловира, фамвира или инозина пранобекса. Однако без подкрепления интерферонами и иммуномодуляторами эффективность лечения с точки зрения элиминации бактериального агента и прекращения репликации вирусов снижается в 1,5–2 раза. Одним из иммуномодуляторов, положительно зарекомендовавшим себя в комплексной противовирусной терапии, является ЭРБИСОЛ®, содержащий низкомолекулярные биологически активные пептиды, активизирующие естественные, эволюционно сформированные контролирующие системы организма, ответственные за поиск и устранение патологических изменений.
Учитывая это, было сформировано 4 группы пациентов по 22 пациента (легкое и среднетяжелое течение, с применением и без применения препарата ЭРБИСОЛ®). Препарат ЭРБИСОЛ® применяли в/м 2 раза в день 20 дней для пациентов с легким течением и 2 подобных курса для пациентов со средней степенью тяжести в дополнение к этиотропной и симптоматической терапии. Группы пациентов были сопоставимы по тяжести течения, возрасту и полу.

Результаты исследования
Применение препарата ЭРБИСОЛ® в комплексной терапии ускоряет выздоровление пациентов в 74,5 % случаев. Его применение снижало болевые и воспалительные симптомы у 68,5 % пациентов в течение 10 дней применения препарата и давало возможность не применять нестероидные противовоспалительные. Для пациентов с легким течением элиминация бактериального возбудителя достигалась с применением препарата ЭРБИСОЛ® в 86 % случаев, а в контрольной группе лишь у 53 % после 1 курса лечения. У людей со средней степенью тяжести – в 65 % и 23 % соответственно (рис. 1).
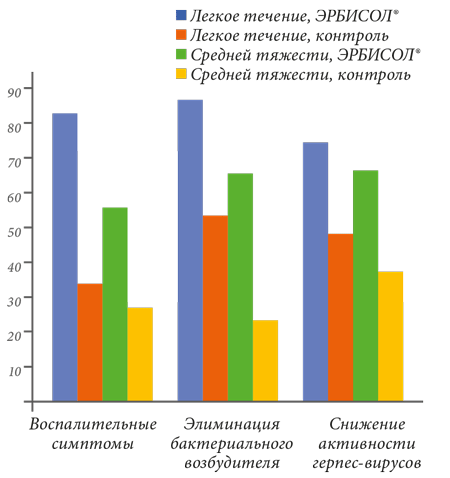
Снижение активности герпес-вирусной инфекции для пациентов с легким течением достигалось в 74 % случаев (у контрольной группы 48 %) и в 65 % случаев со средней тяжестью (у контрольной группы 37 %) после применения препарата ЭРБИСОЛ® в течение 20 дней (рис. 1). Дальнейшее применение средства в комплексе с противовирусными препаратами приводило к отсутствию вирусов в контрольных исследованиях в 89,5 % случаев.
Выводы
Применение препарата ЭРБИСОЛ® позволяет ускорить выздоровление и восстановление работоспособности пациентов с реактивным артритом, сокращая период местного воспаления на 9,7+0,21 дней, повышая эффективность этиотропной терапии в 1,5–2,8 раза, позволяя нормализовать показатели неспецифического воспаления (СОЭ, СРБ) быстрее на 12,4+0,3 дня.
ЭРБИСОЛ® воздействует на иммунный ответ, с одной стороны активируя цитотоксические T-лимфоциты (CD8+), T-киллеры (CD3+16+56+), NK-клетки, ответственные за уничтожение клеток-вирусоносителей, поврежденных клеток, неспособных к регенерации, а также индуцирует синтез α-, β- и γ-интерферонов, повышая их уровень содержания в крови в 4–6 раз, что способствует ускорению элиминации вирусов и внутриклеточных инфекций [15]. ЭРБИСОЛ® потенцирует действие антибиотиков, противовирусных препаратов, экзогенных интерферонов, вместе с тем уменьшая их токсическое побочное действие. С другой стороны, препарат проявляет противовоспалительные свойства, активизируя процессы регенерации тканей, способствует замещению погибших клеток здоровыми, что позволяет отнести ЭРБИСОЛ® к препаратам, снижающим степень тяжести инфекционного заболевания благодаря воздействию на макрофагальное звено, ответственное за репарацию поврежденных клеток и восстановление функциональной активности органов и тканей [15]. Активация T-лимфоцитов, Th1-хелперов и T-киллеров и ингибирования активности Th2-хелперов и B-лимфоцитов значима для восстановления баланса между клеточным и гуморальным звеньями иммунитета, снижения аутоиммунной агрессии и для подавления аллергических реакций, что имеет важное значение при лечении реактивного артрита [7,9].
Данное исследование демонстрирует целесообразность включения препарата ЭРБИСОЛ® в схемы и протоколы лечения реактивных артритов, являясь этиопатогенетически обоснованным и позволяющим значительно повысить эффективность терапии.
![]() Давыдова Т. В.
Давыдова Т. В.
канд. мед. наук, иммунолог, научный сотрудник лаборатории и клинического отдела иммунофармакологии ГУ «Институт микробиологии и иммунологии им. И. И. Мечникова Национальной академии медицинских наук Украины»
 18-фев-2026
18-фев-2026