Імунологічні особливості пацієнтів з Постковідним синдромом

Хвиля захворюваності COVID-19, що охопила всю земну кулю, окрім мільйонів смертей та великих суспільно-економічних змін, лишила по собі значні наслідки для здоров’я людей, що перенесли цю хворобу [1, 2]. Ці наслідки вже отримали свою назву — Постковідний синдром (в англомовних джерелах «Post COVID-19 syndrome», «Long-COVID-19», «Post-acute COVID-19», «Long-term COVID-19 effects» тощо) [3, 4]. Симптоми, ознаки або ненормальні клінічні параметри, що зберігаються два та більше тижнів після COVID-19 і не повертаються до здорового вихідного рівня, потенційно можуть вважатися довготривалими наслідками цього захворювання. Незважаючи на те, що такі зміни в основному зустрічаються в осіб, які перенесли тяжку форму захворювання, стійкі наслідки також спостерігаються і в осіб з легкою інфекцією, які не потребували госпіталізації [4–6].
Не дивлячись на різноманітні прояви та клінічні ознаки Постковідного синдрому, вони мають основні патогенетичні механізми розвитку, що дає можливість виділити головні синдромокомплекси, характерні для Постковіду, а також органи та системи ураження [1, 3, 4, 6]:
Зміни в імунній системі:
- відхилення у популяціях та субпопуляціях Т- і В-клітин, макрофагів і природних клітин-кілерів, з надмірною продукцією запальних цитокінів та хемокінів, що виділяються імунними або неімунними клітинами [7–9];
- відхилення у антитілоутворенні;
- синдром активації макрофагів (MAS) [8, 10];
- низька експресія людського лейкоцитарного антигену D (HLA-DR) [8–12];
- синдром активації тучних клітин (Mast cells (MC);
- MCAS) [10–12];
- автоімунні ураження органів та тканин [11–15].
Відповідь Т- і В-клітин на інфекцію SARS-CoV-2 залишається недостатньо вивченою. Деякі дослідження свідчать про надмірно агресивну імунну відповідь під час гострої інфекції, що веде до імунопатології [7–9, 12]. На відміну від цього, інші звіти свідчать про виснаження або дисфункцію Т-клітин [11–13]. Безуспішну імунну відповідь у хворих з тяжким перебігом на SARS-CoV-2 можна охарактеризувати як «застряглу на рівні вродженого імунітету», тоді як перехід до адаптивного імунітету з виробленням антитіл суттєво корелює зі сприятливими результатами та одужанням. Однак і у пацієнтів з тяжким перебігом COVID-19 також виявляються специфічні для SARS-CoV-2 антитіла [7, 10, 14–17], що піднімає питання: «Чому антитіла пацієнтів у тяжкому стані не контролюють захворювання?». Важка дихальна недостатність при COVID-19 зумовлена синдромом активації макрофагів (MAS) або дуже низькою експресією людського лейкоцитарного антигену D (HLA-DR), що супроводжується глибоким виснаженням лімфоцитів CD4, лімфоцитів CD19 та клітин природних кілерів (NK) [19–21]. «Цитокінова буря» та особливо підвищення рівнів фактору некрозу пухлини-α (TNF-α) та інтерлейкіну-4 (IL-4) й інтерлейкіну-6 (IL-6), які при COVID-19 утворювалися циркулюючими моноцитами, є одними з важливих ланок патогенезу захворювання [13, 16, 18–21].
Тяжкий перебіг COVID‐19 може бути обумовлений аномальною гіперактивацією вірусом SARS-CoV-2 дисфункціональної, ймовірно мутованої частини популяції тучних клітин [10, 21]. Через набуту клональність MC є джерелом хронічного мультисистемного розладу із запальними та алергічними проявами, що може бути одним із ймовірних механізмів розвитку і Постковідного синдрому [22, 23]. Тучні клітини регулюють функції інших імунних клітин, таких як дендритні клітини, моноцити, макрофаги, гранулоцити, Т-клітини, В-клітини та NK-клітини. Шляхом секреції хемокінів та інших медіаторів вони здатні спрямовувати імунні клітини до запаленої тканини з локальним підвищенням проникливості судин [10, 24–26]. Хоча тучні клітини можуть розпізнавати віруси за різними механізмами (наприклад, виявлення Toll-подібного рецептора-3 вірусної дволанцюжкової рибонуклеїнової кислоти (РНК), вірусного сфінгозин-1-фосфату (S1P), що зв’язується з рецепторами S1P, та RIG-I — гена I, розпізнавання незакритої вірусної РНК ретиноєвою кислотою) [21, 27–29], вони також експресують ангіотензин-перетворюючий фермент 2 (ACE2), що є шляхом, за допомогою якого тучні клітини можуть ставати господарями нового коронавірусу людини [22–24], експресуючи багато серинових протеаз (включаючи триптазу), які необхідні вірусу SARS-CoV-2 [23, 27, 29]. Загалом, дослідження повідомляють про поодиноких пацієнтів або про невеликі когорти і на цей час всебічного глибокого імунного профілювання великої кількості госпіталізованих пацієнтів з COVID-19 ще не існує. Ще менше інформації про імунологічні зміни у пацієнтів на Постковідний синдром. У цій роботі нами будуть означені деякі напрями і тенденції імунопатологічних змін у таких пацієнтів.
Ураження нервової системи — синдром хронічної втоми (СХВ/МЕ), синдром Гієна-Барре (ГБС)
Після гострого епізоду SARS-CoV-2 у деяких пацієнтів розвивається синдром хронічної втоми, так званий міалгічний енцефаломієліт (CХВ/ME), який більш ніж 2–3 місяці після мікробіологічного одужання заважає їм повернутися до роботи та звичного образу життя [30–32]. Після подолання гострої інфекції COVID-19 у підгрупи пацієнтів, які перебувають на стадії реконвалесценції, можуть спостерігатися довгострокові побічні ефекти, що характерні для CХВ/ME, такі як стійка втома, головний біль, дифузна міалгія, депресивні симптоми та порушення сну. Дослідження показали, що вірус SARS-CoV-2 здатен проникати через гематоенцефалічний бар’єр до гіпоталамусу, у тому числі через нюхові шляхи, що призводить до вегетативної дисфункції, яка у гострій фазі проявляється як висока температура тіла, а в довгостроковій перспективі веде до порушення регуляції циклів сон/неспання, когнітивної дисфункції та глибокої нестримної анергії й порушення терморегуляції (довготривалий субфібрилітет) [33, 34]. Ймовірний патогенез включає порушення лімфодренажу від мікроглії у головному мозку [30, 35], що проходить через периваскулярні простори уздовж нюхових нервів через ґратчасту кістку (os ethmoidale) до слизової оболонки носа [34, 37], це може пояснити аносмію, що спостерігається у частини хворих на COVID-19. Дані порушення призводять до накопичення прозапальних агентів, постінфекційних цитокінів, таких як інтерферон-гамма та інтерлейкіни [21, 35], які можуть впливати на неврологічний контроль «глімфатичної системи» та викликати появу довготривалих симптомів вірусної інфекції.
SARS-CoV-2 активує та змінює функцію імунної системи, що призводить до хронічного запалення, посилення передачі сигналів шляхом прозапальних цитокінів та порушення функції багатьох типів клітин, включаючи Th1, Th17, Т-регуляторні та природні клітини-кілери. Аутоімунні механізми, такі як молекулярна мімікрія та аутореактивна фонова активація клітин (auto-reactive bystander cell activation), також можуть запускатися під час гострої інфекції [18–21, 37]. Інфекційні агенти з нейроінвазивним потенціалом можуть спричинити запальне та ішемічне ураження клітин та тканин центральної нервової системи, що призводить до дегенерації нейронів, демієлінізації та подальших функціональних порушень, а також можуть спричинити структурні пошкодження мітохондрій, що призведе до зменшення вироблення енергії, зміненого обміну речовин та зниження антиоксидантної функції. Ці процеси можуть лежати в основі симптомів, про які повідомляється при постінфекційному СХВ/МЕ при постковідному синдромі [34–36].
Синдром Гієна-Барре (ГБС) — гостра аутоімунна запальна полірадикулонейропатія, яка проявляється млявими парезами і паралічами, порушеннями чутливості, вегетативними розладами. Передбачуваним патофізіологічним механізмом є молекулярна мімікрія, аберрантна аутоімунна реакція на попередню інфекцію, яка викликає перехресну реакцію на антигени периферичних нервів [37–39]. З цієї причини ГБС можна визначити як пара- або постінфекційне неврологічне захворювання [40]. Пошкодження нервової тканини SARS-CoV-2 може бути пов’язане як з безпосередньою нейроінвазивною дією (через пряме зв’язування з рецепторами ACE2) [39–42], так і з непрямим пошкодженням імунної системи. В останньому випадку механізм імунно-опосередкованого пошкодження може бути зумовлений як надмірною активацією імунної системи з гіперпродукцією інтерлейкіну-4 (IL-4), інтерлейкіну-6 (IL-6) і фактору некрозу пухлини-α (TNF-α), так і генеруванням автоімунної реакції [18, 20, 39–41].
Постковідні реактивні артрити
Іншим наслідком COVID-19 є індукція ревматологічних проявів упродовж захворювання або після інфекції SARS-CoV-2 [43–46]. Ревматологічні симптоми, описані під час COVID-19, можуть бути приховані іншими проявами інфекції. Найчастіше це артралгії на ранній фазі захворювання [47–49]. В іспанському дослідженні у когорті з понад 300 пацієнтів із доведеним COVID-19 у клінічній формі більш ніж у чверті випадків були виявлені артралгії та міалгії [50]. Артрит може бути викликаний різними механізмами. Повідомлялося про випадки гострого артриту, що виникають при появі симптомів COVID-19 [48, 51, 52]. Потенційні механізми виникнення артриту в контексті вірусної інфекції залишаються на стадії гіпотези. Не слід виключати можливість вірусного артриту у випадках раннього артриту, але віремія зафіксована лише у 15 % випадків COVID-19 [53–56]. Дослідження синовіальної рідини за допомогою RT-PCR на наявність SARS-CoV-2 проводилося лише у 3 випадках, але вірус не вдалося виявити [43]. Гістологічний та імунологічний аналіз синовіальної біопсії у пацієнта з раннім артритом виявив запальний синовіальний набряк з периваскулярними та дифузними інфільтратами, що виражає позитивність щодо CD68 (гістіоцитарні клітини), CD3 (Т-клітини) та CD138 (плазматичні клітини) [48, 54, 55]. Механізм реактивного артриту вірогідний при деякому проміжку часу між початком (або діагнозом) COVID-19, початком ревматологічних проявів та характерною негативацією RT-PCR носоглоткового слизу на момент початку запалення у суглобах. Відомо, що вірусні інфекції потенційно індукують реактивні артрити [47–51]. У цьому контексті інтерлейкін 17 може представляти зв’язок між цими двома умовами. Дійсно, IL-17A бере участь у патогенезі як реактивного артриту, так і спондилоартриту загалом [47, 52–54], а також у гіперзапальному стані COVID-19 [49]. Нарешті, неспецифічні механізми заслуговують на обговорення. Артрит може реагувати на замасковану легеневу або інфекцію травного тракту як наслідок COVID-19 [43], а може бути неспецифічним наслідком «цитокінової бурі», що супроводжує тяжкі форми захворювання [54, 55].
COVID-19 може спричинити ревматологічні прояви з можливістю реактивного артриту і вони вимагають особливої уваги та досвіду лікаря при діагностиці. Постковідний реактивний артрит порушує фізіопатологічні проблеми, які на сьогодні залишаються невирішеними.
Мета дослідження — вивчити імунологічні особливості пацієнтів з Постковідним синдромом та оцінити ефективність імунокоригуючої терапії із застосуванням препаратів класу ЕРБІСОЛ® —ЕРБІСОЛОТЕРАПІЇ у комплексному лікуванні Постковідного синдрому та впливу на клінічний стан та імунні показники пацієнтів.
Матеріали та методи. У межах фундаментальної НДР 159/2021 «Вивчити імунні та генетичні кореляти антиінфекційного захисту людини» на базі ДУ «ІМІ НАМН» нами було обстежено 30 осіб з Постковідним синдромом. Було сформовано 3 групи пацієнтів по 10 осіб згідно з перебігом COVID-19:
- легкий;
- середнього ступеню тяжкості;
- тяжкий перебіг.
Пацієнти були обстежені клінічно та імунологічно.

Клітинна ланка вивчалась методом проточної цитометрії, загальні імуноглобуліни методом імуноферментного аналізу (ІФА). Обстеження проводилось на момент звернення пацієнта та після лікування.
Статистична обробка матеріалу проводилася за допомогою стандартної програми офісу Excel в системі Windows, з використанням автоматизованої системи Statistica. Вона включала опис вибірки, знаходження середньої арифметичної, середнє відхилення і помилки середньої арифметичної, визначалися частоти появи ознак, групування даних. Відмінності між парамет-
рами порівняння вважалися статистично значущими при р≤0,05. Для вирішення завдань використані методи рангового кореляційного аналізу по Спирмену, лінійного регресійного аналізу. Достовірність відмінностей абсолютних і відносних показників оцінювалася з використанням критеріїв Манна-Уїтні, Крускалла-Уоллеса, «Т» і «Z» Стьюдента. При оцінці відмінностей якісних показників використовувався хі-квадрат Пірсона.
Результати та обговорення:
- У всіх обстежених було виявлено клінічні ознаки Постковідного синдрому:
- CХВ/ME;
- довготривалий субфібрілітет;
- артралгії.
Було розроблено шкалу скарг за рівнем інтенсивності проявів у пацієнтів з Постковідним синдромом (Табл. 1).
Усі обстежені пацієнти відмічали прояви СХВ/МЕ, що включали слабкість, когнітивні порушення, головний біль, дифузну міалгію, депресивні симптоми та порушення сну. У пацієнтів, що перехворіли на COVID-19 з важким перебігом, ступінь цих проявів був вищім у середньому на 2–2,5 умовні бали у порівнянні з групою пацієнтів із середньо тяжким і легким перебігом та знаходився на рівні 7,7 балів за шкалою, де відсутність скарг на подібні прояви дорівнює 0, а значно виражені прояви, що потребують негайного та постійного медикаментозного лікування — 10 балів (Табл. 1).
Таблиця 1. Інтенсивність клінічних ознак синдрому хронічної втоми, довготривалого субфібрілітету та артралгій у пацієнтів з Постковідним синдромом
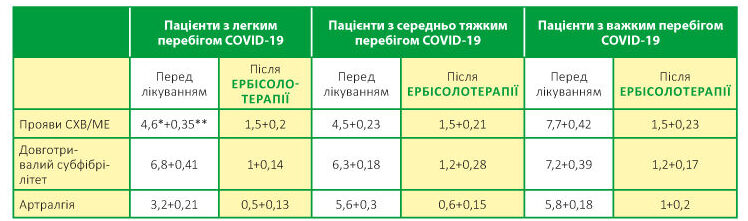
* — бали, що відображають інтенсивність проявів синдромокомплексу, що є частиною Постковідного синдрому
** — середнє відхилення і помилки середньої арифметичної; р≤0,05
Субфібрілітет, що тривав більш ніж 2 тижні, відмічали усі пацієнти, що приймали участь у дослідженні. У всіх групах рівень інтенсивності цього прояву був приблизно однаковим і не мав достовірних відмінностей. При формуванні умовної шкали за цією ознакою бралися до уваги рівень температури тіла та постійність цього симптому. У переважної більшості обстежених температура коливалась від 370 С до 37,40 С, відмічалась протягом усієї доби. У 4-х пацієнтів інколи температура сягала 37,5–37,80 С, двоє з них було із групи з важким перебігом і двоє з середньотяжким (Табл. 1).
Артралгія відмічалась у лише у третини пацієнтів з легким перебігом і не була значно вираженою (у межах 2–3,5 балів). У пацієнтів із інших груп на артралгію скаржилося 90 % обстежених і ступінь інтенсивності був вищім у межах 5,6–5,7 балів (Табл. 1).
При дослідженні було виявлено, що у всіх обстежених пацієнтів є імунологічні зміни. Найхарактернішими були лейкопенія, відносний лімфоцитоз, підвищення B Cells (CD19+), імунорегуляторного індексу (CD4/CD8), NK (CD3-CD16+56+), гетерофільних гемолізинів, лімфоцитотоксичних аутоАТ, загальних Ig G та Ig М, при знижених показниках T cells (CD3+) mean, T activated (CD3+HLADr+), NK T(CD3+CD16+56+) (Табл. 2). Показовим була наявність значних імунологічних змін і у людей, що хворіли на COVID-19 легко, яка не мала достовірної відмінності від інших груп пацієнтів (Табл. 2).
Таблиця 2. Імунологічні зміни при Постковідному синдромі та результати імунореабілітації при застосуванні ЕРБІСОЛОТЕРАПІЇ
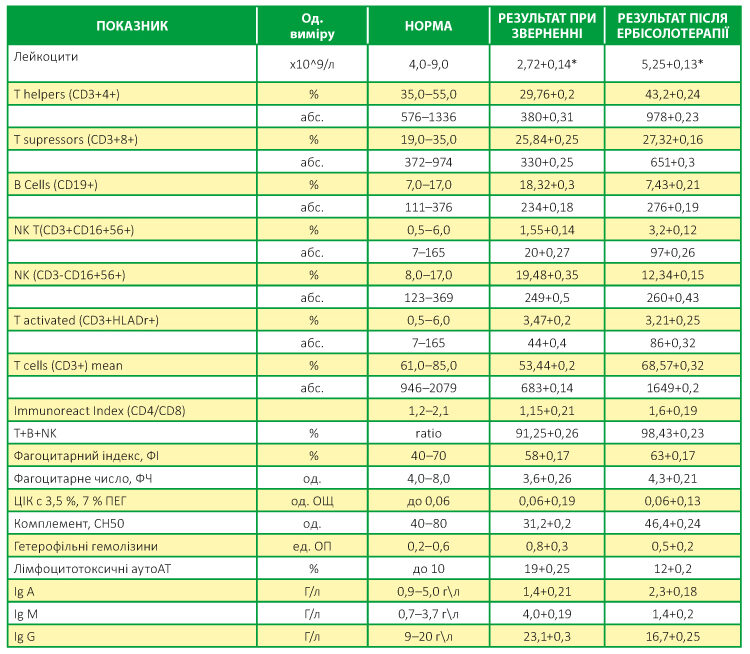
* — середнє відхилення і помилки середньої арифметичної; р≤0,05
Для лікування Постковідного синдрому та корекції імунодефіциту, що викликає патологічні прояви після перенесеного гострого захворювання на COVID-19, було застосовано ЕРБІСОЛОТЕРАПІЮ, яка являє собою комплекс молекулярних імунокоректорів класу ЕРБІСОЛ :
- ЕРБІСОЛ®;
- ЕРБІСОЛ® Екстра;
- препарат «Крила Надії».
Основою розвитку Постковідного синдрому є імунна дисфункція, у результаті якої виникають застряглі запальні процеси, гіперактивація хемокінового та цитокінового шляхів імунної відповіді, ініціалізація та/або активація аутоімунних процесів [8, 9, 12, 30].
Постковідний синдром вражає пацієнтів з будь-яким типом перебігу гострого COVID-19: від легкого до тяжкого, стійкі наслідки спостерігаються і в осіб з легкою інфекцією, які не потребували госпіталізації [2–5]. Розвиток Постковідного синдрому не залежить від преморбідного фону — на Постковідний синдром страждають люди і умовно здорові до епізоду цього захворювання, і люди з хронічними патологіями [3–8]. Ще достовірно не встановлено, чи впливають суттєво стать, вік, етнічна приналежність, вихідний стан здоров’я, доза вірусу або прогресування COVID-19 на ризик розвитку довгострокових наслідків COVID-19 [4–7].
В такій ситуації доцільно застосування широко відомих імунокоректорів, що довго використовуються в комплексному лікуванні імунологічних розладів, автоімунних процесів та лікуванні вірусних інфекцій [56–58].
Препарати класу ЕРБІСОЛ® отримані з тваринної ембріональної тканини та містять в своєму складі комплекс природних небілкових низькомолекулярних органічних сполук негормонального походження [56–59]. Це високо- та низькомолекулярні продукти гідролізу компонентів клітинних мембран. В залежності від співвідношення продуктів гідролізу виділяють ЕРБІСОЛ®, ЕРБІСОЛ® УЛЬТРАфарм, ЕРБІСОЛ® Екстра та препарат «Крила Надії».
Важливим є патогенетичний підхід до підбору комплексу ЕРБІСОЛОТЕРАПІЇ при особливостях імунологічних розладів. В даному лікувальному курсі препарати класу ЕРБІСОЛ® були поєднані, так як комплексне застосування циклу імунокоректорів доповнює один одне, створюючи єдину систему імунотерапії та імунореабілітації [59, 60].
Фармакологічна активність препаратів визначається вмістом у них біологічно активних пептидів, яким властиві імуномодулюючі, репаративні, антиоксидантні й антигіпоксичні ефекти. Препарати класу ЕРБІСОЛ® активують природні, еволюційно сформовані контролюючi системи організму, що відповідають за пошук та усунення патологічних змін [56–59].
Комплексне лікування Постковідного синдрому при використанні ЕРБІСОЛОТЕРАПІЇ займає 22 дні та включає етапи підготовки та введення пацієнта до лікувального курсу, ініціюючого та закріплюючого курсів імунореабілітації з поступовим виведенням пацієнта із лікувальної схеми для оптимальної адаптації захисних сил організму та їх коректної та поступової реабілітації [55, 58, 61]. Рекомендована схема лікування (Табл. 3):
Таблиця 3. Лікувальний курс ЕРБІСОЛОТЕРАПІЇ при Постковідному синдромі розрахований на 22 дні
180 капсул Крила Надії (к) + 20 ампул ЕРБІСОЛ® (е) + 40 ампул ЕРБІСОЛ® Екстра (+)
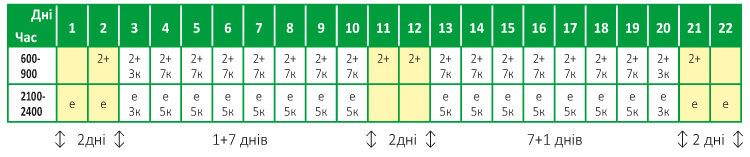
е — 1 (одна) ампула препарату ЕРБІСОЛ® внутришньом’язово
2+ — 2 (дві) ампули препарату ЕРБІСОЛ® Екстра внутришньом’язово;
к — 1 (одна) капсула Крила Надії перорально та запити ½ стаканом води.
Згідно з рекомендаціями виробника ін’єкції препаратів робили на голодний шлунок, (за 1–2 год. до їжі або через 2–3 год. після їжі; чай, соки, воду тощо можна було вживати). Капсули рекомендовано приймати з водою на голодний шлунок, за 30–40 хв. перед ін’єкцією. Через 20–30 хв. після прийому капсул рекомендовано прийняти додатково пів- стакану води та через 10 хв. зробити ін’єкцію. Ввечері капсули призначалися через 3 год. після вечері.
Патогенетична обґрунтованість ЕРБІСОЛОТЕРАПІЇ дозволяє рекомендувати її використання у випадках пост-інфекційних наслідків взагалі та зокрема при терапії Постковідного синдрому, базуючись на фармакологічних ефектах, націлених на відновлення та репарацію організму, завдяки реалізації механізмів ефективного завершення запального процесу, що дозволяє поновити функціонування органів і систем й очистити їх від уражених, дефектних та недієздатних клітин, збалансувати шляхи активації запальних реакцій та вплинути на процеси аутоімунітету. Детоксикація на молекулярному рівні прискорює та нормалізує метаболічні внутріклітинні процеси оновлення, а інтенсифікація тканинного дихання дозволяє позбавитися від агресивного впливу вільних радикалів [58, 60–62].
У результаті проведеного лікування симптоми, пов’язані з проявами Постковідного синдрому у більшості пацієнтів (24 осіб — 80 %), зникли, у незначній інтенсивності лишилися у 1 пацієнта з групи, що перенесла COVID-19 легко, у 2-х пацієнтів з середньотяжким перебігом та у 3-х пацієнтів з важким перебігом COVID-19 (Табл. 1). За шкалою інтенсивності:
- прояви СХВ/МЕ в усіх групах після лікування становили 1,5 балів;
- субфібрілітету — від 1 до 1,2 балів;
- артралгії — 0,5–0,6 бала у групах легкого та середнєтяжкого перебігу COVID-19 і 1 бал у пацієнтів, що перенесли COVID-19 важко (табл. 1).
Імунологічні показники після 22-денного курсу ЕРБІСОЛОТЕРАПІЇ нормалізувалися:
- були відсутні ознаки лейкопенії та лімфоцитозу, стабілізувалися показники клітинної ланки: B Cells (CD19+), імунорегуляторного індексу (CD4/CD8), NK (CD3-CD16+56+), гетерофільних гемолізинів, лімфоцитотоксичних аутоАТ;
- піднялись до нормальних рівнів показники T cells (CD3+) mean, T activated (CD3+HLADr+), NK T(CD3+CD16+56+) (Табл. 2).
Порушення гуморальної ланки імунної системи після курсу лікування були відсутні в усіх групах (Табл. 2).
Після курсу лікування пацієнтам було рекомендовано дотримуватися здорового способу життя та повторне імунне обстеження через 3 місяці з можливістю додаткового імунокоригуючого курсу ЕРБІСОЛОТЕРАПІЇ при повторній появі імунних відхилень.
Висновки

У сучасних реаліях постпандемічного світу проблема відновлення здоров’я для людей, що хворіли на COVID-19, є найважливішою з точки зору підтримання здоров’я популяції та економічно значущою для відновлення працездатності населення. Для вирішення цієї задачі потрібна раціональна та ефективна стратегія обстеження та лікування людей, що страждають на Постковідний синдром. Необхідні своєчасне імунологічне обстеження та корекція відхилень за допомогою використання імунореабілітуючих препаратів з молекулярними механізмами дії, що здатні активувати природні, еволюційно сформовані контролюючі системи організму, які відповідають за пошук та усунення патологічних змін, а також стимулюють репаративні та регенеративні процеси тканин та органів.
Препарати, що відносяться до класу ЕРБІСОЛ®, прискорюють механізми відновлення тканин на клітинному рівні, що були вражені вірусом завдяки активації макрофагально-кілерної ланки імунітету, що спрямована на виявлення і знищення дефектних клітин [56, 58, 61]. Детоксикація на молекулярному рівні прискорює та нормалізує метаболічні внутріклітинні процеси оновлення, а інтенсифікація тканинного дихання дозволяє позбавитися від агресивного впливу вільних радикалів [57–59, 62].
Поєднання активності декількох препаратів класу ЕРБІСОЛ® дозволяє досягти найоптимальнішого ефекту для пацієнта. Імуномодулююча дія препарату ЕРБІСОЛ® Екстра спрямована здебільшого (65–85 %) на активізацію макрофагів М2А (протизапального) фенотипу, що запускають процеси репарації пошкоджених клітин і регенерацію тканин, а також відновлення функціонального стану органів; інший аспект активності препарату (15–35 %) спрямований на активацію кілерної ланки імунного захисту [58, 60, 61]. Препарат ЕРБІСОЛ® активує репаративну та кілерну ланку в рівній мірі, поєднуючи їх у оптимальних пропорціях універсального препарату. Доповнює комплекс препарат «Крила Надії», який ефективно посилює дію препаратів ЕРБІСОЛ® та є важливою частиною ЕРБІСОЛОТЕРАПІЇ.
Механізм ЕРБІСОЛОТЕРАПІЇ базується на активації, в першу чергу, клітин макрофагального ряду, які відіграють важливу роль у процесах реставрації та репарації через NК-клітини та Т-кілери, якi відповідають за знищення ушкоджених клітин, нездатних до регенерації, або аномальних клітин (мутантних, злоякісних, клітин-вірусоносіїв тощо), що значно підвищує регенеративно-репаративний потенціал тканин [59–61]. Активізуючи процеси регенерації печінки, ЕРБІСОЛОТЕРАПІЯ сприяє заміщенню загиблих гепатоцитів здоровими та нормалізації їх функцій; проявляє антиоксидантний та мембраностабілізуючий ефекти на рівні плазматичних мембран. Нормалізація функції печінки призводить до прискореного вилучення з організму токсичних агентів, шкідливих продуктів їх життєдіяльності, а також алергенів. Важливу роль при цьому відіграють тканинні макрофаги печінки Купферовські клітини, які презентують антигени для виникнення нормальної імунної відповіді, запобігаючи розвитку алергічних реакцій. Препарати мають виражені адаптивно-коригуючі властивості, підвищуючи компенсаторні та захисні функції організму та збільшуючи можливість фізичної активності та загального життєвого тонусу [58, 59].
ЕРБІСОЛОТЕРАПІЯ має антигіпоксичні властивості, які реалізуються за рахунок підвищення споживання кисню тканинами та поліпшення клітинного дихання у результаті посилення транспорту електронів у мітохондріях, а також підсиленню віддачі кисню тканинам [56–59]. Препарати нетоксичні та позбавлені кумулятивної токсичності, алергенних, тератогенних, мутагенних і канцерогенних властивостей [61, 62].
Застосування комплексної ЕРБІСОЛОТЕРАПІЇ для лікування Постковідного синдрому має виражену ефективність та сприяє швидкому одужанню пацієнтів і відновленню їх імунного статусу. Дану лікувальну схему рекомендовано використовувати у пацієнтів з Постковідним синдромом для корекції стану здоров’я та запобігання небажаних віддалених наслідків COVID-19 після відповідного імунологічного обстеження та під наглядом лікаря-імунолога.
Література
- Bulut C., Kato Y. Epidemiology of COVID-19. Turk J Med Sci. 2020;50(SI-1):563–570. doi: 10.3906/sag-2004-172. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- del Rio C, Collins LF, Malani P. Long-term health consequences of COVID-19. JAMA 2020; 324: 1723. [PMC free article] [PubMed] [Google Scholar]
- Greenhalgh T, Knight M, A’Court C, et al.. Management of post-acute covid-19 in primary care. BMJ 2020; 370: m3026. [PubMed] [Google Scholar]
- Garner P. Covid-19 at 14 weeks—phantom speed cameras, unknown limits, and harsh penalties. BMJ Opinion, https://blogs.bmj.com/bmj/2020/06/23/paul-garner-covid-19-at-14-weeks-phantom-speed-cameras-unknown-limits-and-harsh-penalties/2020. (2020, accessed 25 October 2020).
- Ladds E, Rushforth A, Wieringa S, et al. Persistent symptoms after COVID-19: qualitative study of 114 “long COVID” patients and draft quality criteria for services. J Infect Dis. Epub ahead of print 14 October 2020. DOI: 10.1101/2020.10.13.20211854. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Michelen M, Manoharan L, Elkheir N, et al. Characterising long-term covid-19: a rapid living systematic review. Glob Public Health. Epub ahead of print 9 December 2020. DOI: 10.1101/2020.12.08.20246025. [CrossRef] [Google Scholar]
- Lim EJ, Ahn YC, Jang ES, et al. Systematic review and meta-analysis of the prevalence of Chronic Fatigue Syndrome/Myalgic Encephalomyelitis (CFS/ME). J Transl Med 2020; 18: 100. [PMC free article] [PubMed] [Google Scholar]
- Petter Brodin. Immune determinants of COVID-19 disease presentation and severity. Nat Med. 2021 Jan;27(1):28-33. doi: 10.1038/s41591-020-01202-8. Epub 2021 Jan 13.
- Cabler SS, French AR, Orvedahl A. A Cytokine Circus with a Viral Ringleader: SARS-CoV-2-Associated Cytokine Storm Syndromes. Trends Mol Med. 2020 Dec;26(12):1078-1085. doi: 10.1016/j.molmed.2020.09.012. Epub 2020 Sep 30. PMID: 33051104 Free PMC article. Review.
- Weidinger C, Hegazy AN, Glauben R, Siegmund B. COVID-19-from mucosal immunology to IBD patients. Mucosal Immunol. 2021 May;14(3):566-573. doi: 10.1038/s41385-021-00384-9. Epub 2021 Feb 19. PMID: 33608656 Free PMC article. Review.
- Kempuraj D., Selvakumar G.P., Ahmed M.E. COVID-19, mast cells, cytokine storm, psychological stress, and neuroinflammation. Neuroscientist. 2020 doi: 10.1177/1073858420941476. [published online ahead of print, 18 July 2020] [PubMed] [CrossRef] [Google Scholar]
- Divij Mathew, Josephine R. Giles, Amy E. Baxter, et al. Deep immune profiling of COVID-19 patients reveals patient heterogeneity and distinct immunotypes with implications for therapeutic interventions. bioRxiv. 2020 May 23. doi: 10.1101/2020.05.20.106401
- Shi Y., Wang Y., Shao C., et al. COVID-19 infection: the perspectives on immune responses. Cell Death Differ. 27, 1451–1454 (2020). [PMC free article] [PubMed] [Google Scholar]
- Vabret N., Britton G. J., Gruber C., et al. Immunology of COVID-19: current state of the science. Immunity (2020), doi:10.1016/j.immuni.2020.05.002 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Weiskopf D., Schmitz K. S., Raadsen M. P., et al. Others, Phenotype of SARS-CoV-2-specific T-cells in COVID-19 patients with acute respiratory distress syndrome. medRxiv (2020) https://www.medrxiv.org/content/10.1101/2020.04.11.20062349v1.abstract. [Google Scholar]
- Giamarellos-Bourboulis EJ, Netea MG, Rovina N, et al. Complex Immune Dysregulation in COVID-19 Patients with Severe Respiratory Failure. Cell Host Microbe. 2020 Jun 10;27(6):992-1000.e3. doi: 10.1016/j.chom.2020.04.009. Epub 2020 Apr 21. PMID: 32320677
- Luo W., Li Y.X., Jiang L.J., Chen Q., Wang T., Ye D.W. Targeting JAK-STAT signaling to control cytokine release syndrome in COVID-19. Trends Pharmacol Sci. 2020;41(8):531–543. doi: 10.1016/j.tips.2020.06.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mangalmurti N., Hunter C.A. Cytokine storms: understanding COVID-19. Immunity. 2020 doi: 10.1016/j.immunol.2020.06.017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mehta P., McAuley D.F., Brown M. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033–1034. doi: 10.1016/S0140-6736(20)30628-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Meyer L., Verbist K.C., Albeituni S. JAK/STAT pathway inhibition sensitizes CD8 T cells to dexamethasone-induced apoptosis in hyperinflammation. Blood. 2020 doi: 10.1182/blood.2020006075. [published online ahead of print, 12 June 2020] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lawrence B Afrin, Leonard B Weinstock, Gerhard J Molderings. Covid-19 hyperinflammation and post-Covid-19 illness may be rooted in mast cell activation syndrome. Int J Infect Dis. 2020 Nov;100:327-332. doi: 10.1016/j.ijid.2020.09.016. Epub 2020 Sep 10.
- Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(5):846–848. doi: 10.1007/s00134-020-05991-x. [Supplemented by: Ruan Q., Yang K., Wang W., Jiang L., Song J. Correction to: Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(6):1294–1297. DOI: 10.1007/s00134-020-06028-z.] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Afrin L.B., Pöhlau D., Raithel M. Mast cell activation disease: an underappreciated cause of neurologic and psychiatric symptoms and diseases. Brain Behav Immun. 2015;50:314–321. doi: 10.1016/j.bbi.2015.07.002. [PubMed] [CrossRef] [Google Scholar]
- Criado P.R., Pagliari C., Criado R.F.J., Marques G.F., Belda W., Jr. What the physicians should know about mast cells, dendritic cells, urticaria, and omalizumab during COVID-19 or asymptomatic infections due to SARS-CoV-2? Dermatol Ther. 2020 doi: 10.1111/dth.14068. [published online ahead of print, 25 July 2020] [PubMed] [CrossRef] [Google Scholar]
- Afrin L.B., Butterfield J.H., Raithel M., Molderings G.J. Often seen, rarely recognized: mast cell activation disease–a guide to diagnosis and therapeutic options. Ann Med. 2016;48(3):190–201. doi: 10.3109/07853890.2016.1161231. [PubMed] [CrossRef] [Google Scholar]
- Abraham S.N., St John A.L. Mast cell-orchestrated immunity to pathogens. Nat Rev Immunol. 2010;10:440–452. [PMC free article] [PubMed] [Google Scholar]
- Afrin L.B., Ackerley M.B., Bluestein L.S. Diagnosis of mast cell activation syndrome: a global “consensus-2” Diagnosis (Berl) 2020 doi: 10.1515/dx-2020-0005. /j/dx.ahead-of-print/dx-2020-0005/dx-2020-0005.xml [published online ahead of print, 22 April 2020] [PubMed] [CrossRef] [Google Scholar]
- Haenisch B., Fröhlich H., Herms S., Molderings G.J. Evidence for contribution of epigenetic mechanisms in the pathogenesis of systemic mast cell activation disease. Immunogenetics. 2014;66(5):287–297. doi: 10.1007/s00251-014-0768-3. [PubMed] [CrossRef] [Google Scholar]
- Ibelgaufts H. 2020. “Mast Cells” in COPE: Cytokines and Cells Online Pathfinder Encyclopaedia. Available at: http://www.cells-talk.com/index.php/page/copelibrary?key=mast %20cells [Accessed 2 August 2020] [Google Scholar]
- Jason LA, Porter N, Brown M, et al. CFS: a review of epidemiology and natural history studies. Bull IACFS ME 2009; 17: 88–106. [PMC free article] [PubMed] [Google Scholar]
- Prins JB, van der Meer JW, Bleijenberg G. Chronic fatigue syndrome. Lancet 2006; 367: 346–355. [PubMed] [Google Scholar]
- Naess H, Sundal E, Myhr K-M, et al.. Postinfectious and chronic fatigue syndromes: clinical experience from a tertiary-referral centre in Norway. In Vivo 2010; 24: 185–188. [PubMed] [Google Scholar]
- Clayton EW. Beyond myalgic encephalomyelitis/chronic fatigue syndrome: an IOM report on redefining an illness. JAMA 2015; 313: 1101–1102. [PubMed] [Google Scholar]
- Sonia Poenaru, Sara J Abdallah, Vicente Corrales-Medina, Juthaporn Cowan. COVID-19 and post-infectious myalgic encephalomyelitis/chronic fatigue syndrome: a narrative review. Ther Adv Infect Dis. 2021 Apr 20;8:20499361211009385. doi: 10.1177/20499361211009385. eCollection Jan-Dec 2021.
- Romero-Sánchez C.M., Díaz-Maroto I., Fernández-Díaz E. Neurologic manifestations in hospitalized patients with COVID-19: the ALBACOVID registry. Neurology. 2020 doi: 10.1212/WNL.0000000000009937. [published online ahead of print, 01 June 2020] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sestili P., Stocchi V. Repositioning chromones for early anti-inflammatory treatment of COVID-19. Front Pharmacol. 2020;11:854. doi: 10.3389/fphar.2020.00854. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Imran Hasan, K M Saif-Ur-Rahman, Shoma Hayat, et al. Guillain-Barré syndrome associated with SARS-CoV-2 infection: A systematic review and individual participant data meta-analysis. J Peripher Nerv Syst. 2020 Dec;25(4):335-343. doi: 10.1111/jns.12419. Epub 2020 Nov 5.
- Abu-Rumeileh S, Abdelhak A, Foschi M, Tumani H, Otto M. Guillain-Barré syndrome spectrum associated with COVID-19: an up-to-date systematic review of 73 cases. J Neurol. 2021 Apr;268(4):1133-1170. doi: 10.1007/s00415-020-10124-x. Epub 2020 Aug 25. PMID: 32840686 Free PMC article.
- Uncini A, Vallat JM, Jacobs BC. Guillain-Barré syndrome in SARS-CoV-2 infection: an instant systematic review of the first six months of pandemic. J Neurol Neurosurg Psychiatry. 2020 Oct;91(10):1105-1110. doi: 10.1136/jnnp-2020-324491. Epub 2020 Aug 27. PMID: 32855289
- Pelea T, Reuter U, Schmidt C, Laubinger R, Siegmund R, Walther BW. SARS-CoV-2 associated Guillain-Barré syndrome. J Neurol. 2021 Apr;268(4):1191-1194. doi: 10.1007/s00415-020-10133-w. Epub 2020 Aug 8. PMID: 32770414 Free PMC article.
- Agosti E, Giorgianni A, D’Amore F, Vinacci G, Balbi S, Locatelli D. Is Guillain-Barrè syndrome triggered by SARS-CoV-2? Case report and literature review. Neurol Sci. 2021 Feb;42(2):607-612. doi: 10.1007/s10072-020-04553-9. Epub 2020 Jul 9. PMID: 32643136 Free PMC article. Review.
- Sansone P, Giaccari LG, Aurilio C, et al. Post-Infectious Guillain-Barré Syndrome Related to SARS-CoV-2 Infection: A Systematic Review. Life (Basel). 2021 Feb 21;11(2):167. doi: 10.3390/life11020167. PMID: 33670000 Free PMC article. Review.
- Daniel Wendling, Frank Verhoeven, Mickael Chouk, Clément Pratia. Can SARS-CoV-2 trigger reactive arthritis? Joint Bone Spine. 2021 Jan; 88(1): 105086. Published online 2020 Oct 27. doi: 10.1016/j.jbspin.2020.105086 PMCID: PMC7590820
- Richez C., Flipo R.M., Berenbaum F. Managing patients with rheumatic diseases during the COVID-19 pandemic: the French Society of Rheumatology answers to most frequently asked questions up to May 2020. Joint Bone Spine. 2020 doi: 10.1016/j.jbspin.2020.05.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mikuls T.R., Johnson S.R., Fraenkel L. American College of Rheumatology Guidance for the management of rheumatic disease in adult patients during the COVID-19 pandemic: version 2. Arthritis Rheumatol. 2020 doi: 10.1002/art.41437. [Online ahead of print] [PubMed] [CrossRef] [Google Scholar]
- Felten R., Chatelus E., Arnaud L. How and why are rheumatologists relevant to COVID-19? Joint Bone Spine. 2020;87:279–280. [PMC free article] [PubMed] [Google Scholar]
- Liew J.W., Castillo M., Zaccagnino E. Patient-reported disease activity in an axial spondyloarthritis cohort during the COVID-19 pandemic. ACR Open Rheumatol. 2020 doi: 10.1002/acr2.11174. [Online ahead of print] [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Quartuccio L., Valent F., Pasut E. Prevalence of COVID-19 among patients with chronic inflammatory rheumatic diseases treated with biologic agents or small molecules: a population-based study in the first two months of COVID-19 outbreak in Italy. Joint Bone Spine. 2020 doi: 10.1016/j.jbspin.2020.05.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Joob B., Wiwanitkit V. Arthralgia as an initial presentation of COVID-19: observation. Rheumatol Int. 2020;40:823. [PMC free article] [PubMed] [Google Scholar]
- López-González M.D., Peral-Garrido M.L., Calabuig I. Case series of acute arthritis during COVID-19 admission. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-217914. [PubMed] [CrossRef] [Google Scholar]
- Saricaoglu E.M., Hasanoglu I., Guner R. The first reactive arthritis case associated with COVID-19. J Med Virol. 2020 doi: 10.1002/jmv.26296. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Liew I.Y., Mak T.M., Cui L. A case of reactive arthritis secondary to coronavirus disease 2019 infection. J Clin Rheumatol. 2020;26:233. [PMC free article] [PubMed] [Google Scholar]
- Ono K., Kishimoto M., Shimasaki T. Reactive arthritis after COVID-19 infection. RMD Open. 2020;6:e001350. [PMC free article] [PubMed] [Google Scholar]
- Yokogawa N., Minematsu N., Katano H. Case of acute arthritis following SARS-CoV-2 infection. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218281. [PubMed] [CrossRef] [Google Scholar]
- Alivernini S., Cingolani A., Gessi M. Comparative analysis of synovial inflammation after SARS-CoV-2 infection. Ann Rheum Dis. 2020 doi: 10.1136/annrheumdis-2020-218315. [Online ahead of print] [PubMed] [CrossRef] [Google Scholar]
- Фесенкова В.Й., Драннік Г.М., Дріянська В.Є., [et al.]. Дослідження in vitro впливу препаратів ербісол на продукцію інтерлейкіну-2 та γ-інтерферону т-хелперами і типу здорових донорів // Лабораторна діагностика. — 2003. — № 2. — С. 37–40.
- Гиріна О. М., Вітик Л. Д., Романюк Л. І., [et al.]. Оптимізація лікування хворих на поліноз шляхом застосування препарату ЕКСТРА ЕРБІСОЛ // Збірник наукових праць співробітників НМАПО ім. П.Л.Шупика. — Київ. — 2006. — Вип. 15, кн. 2. — С. 206–211.
- Корнилина Е.М., Николаенко А.Н., Вовк А.Д., [et al.]. Характеристика фенотипа лейкоцитов крови больных хроническим гепатитом С в динамике лечения препаратом ЭРБИСОЛ® УЛЬТРАФАРМ // Імунологія та алергологія. — 2006. — № 4. — С. 69–71.
- Дранник Г.Н., Курченко А.И., Фесенкова В.Й., [et al.]. Изучение влияния препаратов класса Эрбисол® на продукцию цитокинов мононуклеарами периферической крови здоровых доноров и онкологических больных // Вісник фармакології та фармації. — 2006. — № 7. — С. 29–32.
- Базыка Д., Гладкий А., Корнилина Е., Николаенко А. Особенности влияния препаратов класса Эрбисол на экспрессию поверхностных маркеров клеток крови здоровых доноров и больных с иммунодепрессией клеточного иммунитета in vitro и в динамике лечения // Вісник фармакології та фармації. — 2009. — № 1. — С. 39–47.
- Лазарев К.Л., Сатаева Т.П. Перспективы применения иммуномодуляторов эмбрионального происхождения в качестве ингибиторов феномена эпителиально-мезенхимальной трансформации // Крымский журнал экспериментальной и клинической медицины. — 2012. — Т. 2, № 1–2 (5–6). — С. 83–85.
- Неміровська Н.В. Динаміка змін імунологічного статусу та ліпідного обміну у хворих на поліноз з холестерозом жовчного міхура на фоні лікування // Астма та алергія. — 2013. — № 1. — С. 50–54.
![]() Давидова Т.В., кандидат медичних наук,
Давидова Т.В., кандидат медичних наук,
імунолог, старший науковий співробітник
лабораторії імунореабілітології ДУ
«Інститут мікробіології та імунології ім. І.І. Мечникова
Національної академії медичних наук України»

 11-фев-2026
11-фев-2026
