АМИКСИН®IC современное противовирусное средство широкого спектра действия
В современном мире и в той ситуации, в которой оказалось мировое сообщество из-за пандемии COVID-19, очень важным является правильная тактика врача по лечению и профилактике вирусных заболеваний, как сезонных, так и пандемических. Несмотря на отсутствие четко разработанного протокола лечения и специфических противовирусных средств, мировое научное сообщество активно изучает возможность применения для лечения COVID-19 уже известных и проверенных препаратов [1–4]. И знакомый нам АМИКСИН® IC является одним из ключевых в решении этой задачи [2]. Американские ученые Sean Ekins, Thomas R. Lane и Peter B. Madrid в своей недавней статье в крупном научном издании Springer Link высказываются в пользу этого известного препарата для лечения опасных вирусных заболеваний и в том числе для профилактики и лечения COVID-19 на основании богатого медицинского опыта применения и многочисленных исследований препарата за последние десятки лет [2].
«Тилорон (Tiloronum, действующее вещество препарата АМИКСИН® IC) — известен уже более 50 лет как препарат широкого спектра действия. Это низкомолекулярный препарат для перорального приема с высокой биодоступностью, который был первоначально открыт в США и в настоящее время используется в клинических условиях в качестве противовирусного средства в странах Африки, Европейского союза, Украине, Казахстане, Беларуси, России, Армении, Грузии, Кыргызстане, Молдове, Туркменистане и Узбекистане. За прошедшие годы появилось множество клинических и доклинических исследований, подтверждающих его широкий спектр противовирусной активности. Совсем недавно мы выявили дополнительную многообещающую противовирусную активность в отношении вирусов, вызывающих такие опасные заболевания как Ближневосточный Респираторный Синдром, Chikungunya, лихорадки Эбола и Марбург, что подчеркивает, что это хорошо известное лекарство может применяться против новых вирусов. Это, в свою очередь, может дать информацию о типах лекарств, которые нам нужны для вирусных вспышек, таких как новый коронавирус, возбудитель тяжелого острого респираторного синдрома SARS-CoV-2.
Западная медицина долгое время игнорировала Тилорон (АМИКСИН® IC) во многих отношениях, но он заслуживает дальнейшей переоценки в свете текущих и будущих потребностей в противовирусных препаратах широкого спектра действия», — говорится в издании [2].
Кроме того, потенциальная противовирусная активность тилорона in vitro в отношении SARS-CoV-2 и других подтипов коронавируса была продемонстрирована в двух других исследованиях. В одном из них, проведенном в Institut Pasteur в Южной Корее, тилорон вошел в перечень из 24 препаратов, для которых концентрация полумаксимального ингибирования (IC50) вирусной репликации SARS-CoV-2 находилась в пределах 0,1–10 uM [55]. В еще одном исследовании тилорон также был отобран в качестве одного из 36 препаратов, активность которых исследовалась в отношении четырех штаммов коронавируса способных инфицировать человека [56].
Эпидемиологическая актуальность
За последние 5 лет было зафиксировано 2 крупных вспышки вируса лихорадки Эбола в Африке [1] и вируса Зика в Бразилии [2], и в настоящее время мир охвачен пандемией COVID-19 (SARS-CoV-2), вызывающего тяжелый острый респираторный синдром [2, 4, 5]. Все эти вирусы могут быстро распространяться и вызывать человеческие и огромные финансовые потери. Однако, несмотря на всю опасность и тяжесть вышеперечисленных вирусных инфекций, их общая заболеваемость не сравнима с уровнем заболеваемости и последствиями широко распространенных вирусных инфекций, такими как грипп [6], ВИЧ [7] и гепатиты В и С [8], которые ежегодно убивают на порядок больше людей. Новые вирусы привлекают значительное внимание из-за отсутствия доступных методов лечения и страха перед неизвестностью. Это также указывает на необходимость в противовирусных препаратах широкого спектра, которые можно использовать для любого нового или появляющегося вируса, вызывающего заболевание у людей [9–11]. Одним из таких многообещающих лекарств является АМИКСИН® IC [10, 11].
Фармакологическое действие АМИКСИНА® IC
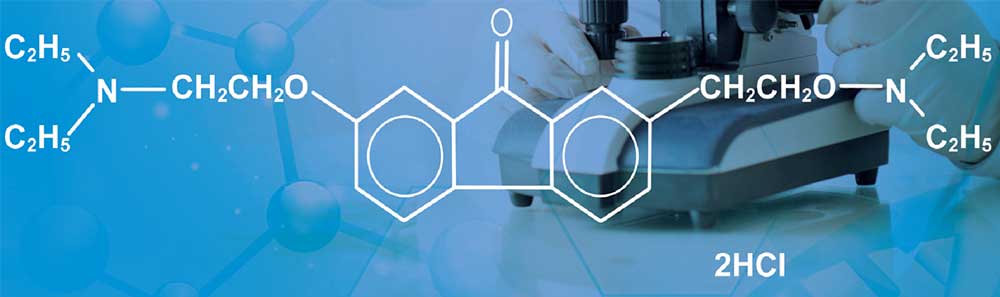
Рис. 1. Амиксин. Структурная формула
АМИКСИН® IC — дигидрохлорид тилорона (тилорон, 2,7-бис [2- (диэтиламино) этокси] -9H-флуорен-9-он) представляет собой низкомолекулярное (410,549 Да) соединение, которое является биодоступным при пероральном введении (рис. 1) [12–14]. Лекарство обычно используется в форме соли дигидрохлорида и имеет желтый/оранжевый цвет. Тилорон хорошо растворим в воде и обладает высокой проницаемостью: хорошо всасывается при пероральном введении, способен проникать через гистогематические барьеры (в частности, через гематоэнцефалический), поступая во все очаги локализации вирусов в организме [15, 16]. Низкомолекулярный синтетический индуктор интерферона, который стимулирует образование в организме всех типов интерферонов (ИФН) — альфа, бета, гамма и лямбда [4, 13, 17]. Основными продуцентами интерферона в ответ на введение АМИКСИНА ® IC являются клетки эпителия кишечника, гепатоциты, T-лимфоциты, нейтрофилы и гранулоциты [18–20]. После приема внутрь максимум продукции интерферона определяется в последовательности кишечник — печень — кровь через 4–24 ч [21, 21]. АМИКСИН® IC обладает иммуномодулирующим и противовирусным эффектом. Последние годы проводятся исследования по противоопухолевой активности препаратов индукторов интерферонов [2, 16].
АМИКСИН® IC эффективен против различных вирусных инфекций, помимо индукции выработки ИФН, для АМИКСИНА® IC показан прямой противовирусный эффект, связанный с его способностью связываться с нуклеиновыми кислотами вирусов [25, 26].
АМИКСИН® IC эффективен против широкого спектра вирусов как ДНК-содержащих (герпесвирусы, в том числе цитомегаловирус, вирус Эпштейн Барр), так и РНК-содержащих (ортомиксовирусы, пикорнавирусы, рабдовирусы, ретровирусы, тогавирусы и другие) [27–29], а также гриппа, ОРВИ, вирусов гепатита. Механизм антивирусного действия связан с ингибированием трансляции вирус-специфических белков в инфицированных клетках, в результате чего подавляется репродукция вирусов [30, 31].
АМИКСИН® IC также обладает иммуномодулирующим эффектом — усиливает антителообразование, снижает степень иммунодепрессии, восстанавливает соотношение Т-супрессоров и Т-хелперов, запуская иммунные механизмы, направленные на предотвращение распространения и внутриклеточной персистенции возбудителя в организме [22, 26, 31].
Противовирусное и иммуномодулирующее действие АМИКСИНА® IC обусловливает его активность в отношении широкого спектра патогенов не только вирусной, но также бактериальной, хламидийной, грибковой и микоплазменной этиологии [32–34]. После профилактического курса препарата терапевтическая концентрация ИФН может сохраняться в течение длительного времени — до 8 нед. Повышенные титры ИФН предотвращают инфицирование незараженных клеток [35, 36].
ИСТОРИЯ ОТКРЫТИЯ И ИССЛЕДОВАНИЙ
 АМИКСИН® IC — лекарственное средство из группы индукторов интерферона, открытое уже более 50 лет назад в период прорыва мировой науки в области иммунологии на фоне высокой конкуренции между учеными Запада и СССР во времена «холодной войны» [1, 37].
АМИКСИН® IC — лекарственное средство из группы индукторов интерферона, открытое уже более 50 лет назад в период прорыва мировой науки в области иммунологии на фоне высокой конкуренции между учеными Запада и СССР во времена «холодной войны» [1, 37].
«Гонка вооружений» во всех сферах науки и техники между капиталистическими странами и соцлагерем привела к активному развитию в различных сферах науки и техники и в том числе медицинской науки. Действующее вещество Тилорон (Tiloronum) было открыто и запатентовано в США в 1968 году [2, 3, 38]. Первыми же публикациями в научном журнале стали статьи Gerald D. Mayer и Russell F. Krueger в журнале Science — одном из наиболее авторитетных научных изданий (импакт-фактор для 1981 года превышает 138) [1-4, 37, 38]. Вещество Тилорон запатентовали в США в 1968 году и попытались сделать из него лекарство, но эти попытки окончились неудачей в 1970-х. В СССР на основе тилорона фармацевты сделали лекарственное средство Амиксин, который применяется в Украине, России и еще нескольких странах [38-40]. Первые испытания безопасности и индукции интерферона на людях датируются 1971 годом [38-40]. В 1973 в журнале «Антибиотики» была опубликована статья Зинаиды Виссарионовны Ермольевой (ученого, которая первой синтезировала пенициллин в СССР и наладила его промышленное производство) с соавторами, посвященная интерфероногенным свойствам тилорона [2, 39]. Эта статья, по-видимому, разбудила интерес к Тилорону советских ученых. В 1975 г. в Физико-химическом институте АН УССР (Одесса) Литвинова Л.А. с сотрудниками впервые в СССР синтезировала тилорон [3, 40].
Механизм действия АМИКСИНА® IC
Что такое система интерферона и как работают индукторы интерферона?
Система интерферона играет одну из центральных ролей в иммунорегуляции, включает механизмы врожденного и адаптивного иммунного ответа, является первой линией защиты от вирусных и других внутриклеточных инфекций, а также участвует в поддержании гомеостаза организма. ИФН и их индукторы, являясь центральными пусковыми молекулами системы ИФН, эффективно предупреждают самые ранние негативные процессы взаимодействия носителей чужеродной информации с организмом и занимают приоритетное место среди современных средств антивирусной и противораковой терапии [10, 14]. К настоящему времени описано более 300 различных эффектов ИФН, которые и определяют медицинскую значимость препаратов этого типа [14, 17, 20]. Интересно то, что in vitro противовирусная активность АМИКСИНА® IC наблюдается в отношении MERS-CoV и CHIKV в клетках Vero 76, дефектных по продукции интерферонов. Это свидетельствует о том, что за противовирусную активность отвечают различные механизмы врожденного иммунитета, и подтверждает факт, что АМИКСИН® IC воздействует на несколько мишеней, которые способствуют его общей
противовирусной активности [20, 33, 36].
Основные биологические эффекты ИФН включают:
- подавление роста внутриклеточных и внеклеточных инфекционных агентов вирусной и невирусной природы (хламидии, риккетсии, простейшие, бактерии);
- антипролиферативную активность;
- антитуморогенный эффект;
- антимутагенный эффект;
- антитоксическое действие;
- радиопротективный эффект;
- влияние на продукцию антител;
- стимуляцию макрофагов, усиление фагоцитоза;
- активацию цитотоксического действия сенсибилизированных лимфоцитов на клетки-мишени;
- активацию естественных киллерных клеток;
- усиление экспрессии антигенов главного комплекса гистосовместимости;
- усиление или ингибицию активности ряда клеточных ферментов;
- усиление цитотоксического действия двуспиральных РНК;
- подавление гиперчувствительности замедленного типа;
- многочисленные изменения клеточных мембран;
- стимуляцию выработки факторов и молекул адгезии и другое [10, 13, 19, 38].
Известно, что АМИКСИН® IC является иммуномодулятором как in vivo [15, 36], так и in vitro [27]. Исследования показывают, что тилорон имеет широкое и комплексное воздействие путем активации множества различных факторов иммунного ответа.
У мышей, получавших АМИКСИН® IC после заражения maEBOV (вирусом Эбола), соотношение провоспалительных и противовоспалительных цитокинов и хемокинов [54] в сравнении с контрольными группами позволяло избежать «цитокинового шторма». Также было показано, что тилорон (действующее вещество АМИКСИНА® IC) увеличивает in vivo секрецию макрофагами IL-6, TNF-a и IL-12 у незараженных мышей линии BALB/c [22]. Многочисленные данные научных исследований АМИКСИНА® IC in vivo и in vitro позволяют сделать вывод об отсутствии опасности «цитокинового шторма» в результате выработки провоспалительных цитокинов в ответ на его применение, что могло бы усугубить клинические симптомы некоторых вирусных инфекций, в том числе SARS-CoV-2 или гриппа [23] — это является неоспоримым преимуществом данного препарата.
Этиотропное действие АМИКСИНА® IC связывают со способностью стимулировать синтез ИФН I типа, основная функция которого заключается в защите организма от вирусных инфекций [17, 23]. Роль ИФН заключается в подавлении трансляции вирусспецифических мРНК через протеинкиназу R(PKR); в индукции синтеза 2’-5’-олиго-А-синтетазы; в блокаде активности вирусной РНК-полимеразы с помощью Мх-белка, являющегося продуктом индукции ИФН I типа, и в контроле апоптоза инфицированных клеток. Помимо прямого этиотропного действия, АМИКСИН® IC обладает выраженной иммуномодулирующей активностью, что позволяет отнести его к бифункциональным препаратам [20, 21].
Интерферон-гамма (ИФН-γ) является одним из основных веществ в противовирусной защите организма. При активации соответствующих клеток индуктором активируются кодирующие белки интерфероногены [13, 24]. ИФН выделяются в межклеточное пространство и связываются клеточными рецепторами, в результате чего происходит синтез протеинов. Данные протеины повышают резистентность клеток к инфекционному агенту и способны переноситься на другие клетки, которые ранее не имели контакта ни с антигеном, ни с ИФН [11]. Продуцируют ИФН-γ в основном активированные Т-лимфоциты, NK-клетки и активированные макрофаги. ИФН-γ продуцируется изначально как CD4+ Т-лимфоцитами (хелперные клетки), так и CD8+Т-лимфоцитами (цитотоксические). После дифференцировки Т-лимфоцитов на Th-1 и Th-2 лимфоциты вырабатывать ИФН-γ могут только Th-1 лимфоциты. Также ИФН-γ продуцируется и В-клетками. Через 48–72 часа после воздействия активаторов наблюдается максимальная экспрессия гена ИФН-γ [31].
Благодаря усилению ИФН-γ синтеза макрофагального протеина NRAMP1 происходит повышение резистентности макрофагов к внутриклеточным микроорганизмам. ИФН-γ усиливает экспрессию компонентов комплекса рекогниции липополисахаридов МБТ (TLR-2, TLR-4, CD 14), из-за чего усиливается способность макрофагов DC распознавать и захватывать инфекционные агенты, происходит активация антигенпрезентирующих клеток и запуск иммунного ответа в целом [7, 8].
Противовирусная эффективность АМИКСИНА® IC и наблюдение за его отсутствием in vitro анти-EBOV-активности в IFN-дефицитных клеточных линиях подтверждает, что препарат может работать, активируя определенные механизмы врожденного иммунитета, которые подавляют репликацию вируса. Одной из возможных мишеней является воздействие на сигнальный путь RIG-подобного рецептора (RLR), который распознает внутриклеточную вирусную РНК и вызывает клеточный ответ, который приводит к индукции ИФН [41] (рис. 2). Точный механизм этого еще до конца не изучен, но некоторые данные подтверждают эту гипотезу: активация сигнальных путей RLR приводит к продукции ИНФ [41, 42], хорошо известной активности тилорона. Тилорон вызывает быстрое увеличение митохондриального потенциала (через 30 минут), что может отражать активность прямого сигнального партнера RIG-I, называемого митохондриальным антивирусным сигнальным белком (MAVS) [41]. Было показано, что передача сигналов RLR и белок MAVS являются критическим медиатором репликации вируса [41]. Данные связывания in vitro показывают, что тилорон может напрямую связываться с RIG-I человека, хотя и слабо, когда анализ проводится в простом буфере без других клеточных компонентов [41] (рис. 2).
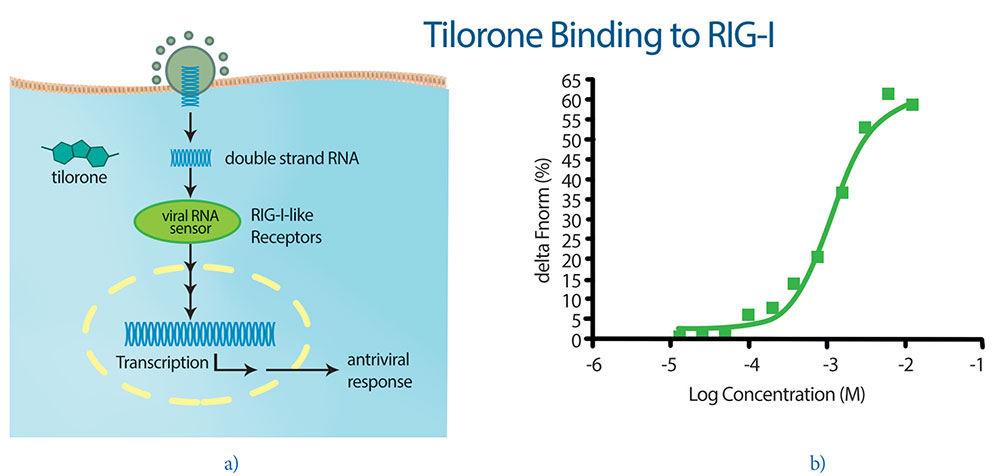
Рис 2. (а) Механизм действия Амиксина® IC — активация врожденного иммунитета, по механизму RIG-I-подобного рецептора, который индуцирует ИФН и активирует клеточный противовирусный ответ. (b) Данные микротермофореза (MST) связывания Амиксина® IC с рецепторами вирусной РНК RIG-I человека демонстрируют низкое сродство (EC50 = 0,5 мМ) в данной бесклеточной модели in vitro [41].
Лизосомотропный механизм АМИКСИН® IC представляет собой амфифильное катионное соединение, которое увеличивает лизосомный pH и ингибирует АТФ-зависимое окисление в лизосомах, что приводит к замедлению или угнетению проникновения вируса внутрь клетки [29]. Недавно было подтверждено, что препарат является лизосомотропным с IC50 (~4 мкМ) наравне с хорошо известным лизосомотропным соединением хлорохином [30]. Катионные амфифильные препараты недавно были предложены в качестве отправной точки для создания противовирусных препаратов широкого
спектра действия [2, 10, 28].
Клиническое применение АМИКСИНА® IC
Наибольший клинический опыт применения АМИКСИНА® IC накоплен при его использовании в качестве средства терапии и профилактики гриппа и других ОРВИ, при этом в проведенных контролируемых клинических исследованиях приняли участие более 39 тыс. пациентов [42–46]. Включение препарата АМИКСИН® IC в комплексную терапию острых и хронических заболеваний верхних дыхательных путей приводит к сокращению периода общей интоксикации во время обострения (головная боль, общая слабость, нормализация температуры тела) [42, 43, 47–50]. Возможность и целесообразность применения препарата АМИКСИН® IC в комплексной терапии этих заболеваний обусловлены его влиянием на бактериально-вирусную флору ротоглотки в виде снижения вирусной нагрузки, коррекции вторичного иммунодефицитного состояния при этой патологии. АМИКСИН® IC целесообразно применять для профилактики и лечения данной патологии с учетом снижения частоты рецидивов заболевания в отдаленном периоде наблюдения. АМИКСИН® IC имеет широкий спектр показаний и применяется у взрослых и детей в комплексной терапии иммунодефицитных состояний, клинически проявляющихся в форме острых и хронических рецидивирующих инфекционно-воспалительных заболеваний [48, 50, 51–54].
Так, в РМАПО на базе ГКБ им. С.П. Боткина, Москва, проведено исследование, посвященное изучению профилактического эффекта АМИКСИНА® IC в отношении гриппа и ОРВИ среди медицинских работников стационаров Москвы [42, 43]. Исследование проводилось в соответствии с приказом Комитета здравоохранения г. Москвы от 3.09.98 № 497 «О проведении профилактики гриппа и ОРВИ АМИКСИНОМ® IC» в осенне-зимний период 1998–1999 гг. Общее число обследованных составило 39 051 человек. Данное исследование показало, что заболеваемость ОРВИ в группе, получавшей АМИКСИН® IC, снизилась почти в 3,4 раза по сравнению с контрольной группой.
АМИКСИН® IC разрешен к применению для лечения, профилактики гриппа и других ОРВИ у взрослых, а также у детей старше 7 лет для лечения осложненных и неосложненных форм этих заболеваний. У детей применяется детская форма препарата (таблетки 60 мг). Эффективность и безопасность применения детской формы АМИКСИНА® IC доказана и при герпес-вирусных инфекциях у часто болеющих детей [22, 23], а также в составе комплексной терапии энтеровирусных менингитов [24]. Проведено более 13 клинических крупномасштабных исследований препарата, в том числе контролируемых рандомизируемых испытаний, доказавших эффективность препарата. Исследователи изучают активность АМИКСИНА® IC для лечения опасных вирусных заболеваний, таких как Ближневосточный Респираторный Синдром, Chikungunya, лихорадки Эбола и Марбург, и получены первые обнадеживающие результаты [44–47, 50–54].
ЗАКЛЮЧЕНИЕ
АМИКСИН® IC— современный противовирусный препарат широкого спектра действия, предназначенный для профилактики и лечения острых и хронических вирусных инфекций, а также некоторых других заболеваний.
 Преимущества препарата:
Преимущества препарата:
- Активен на всех этапах вирусного процесса: контакт с больным, начало заболевания, разгар, затяжное течение и хронизация процесса.
- Активирует несколько видов интерферонов: альфа, бета, гамма, лямбда.
- Повышает выработку интерферона лямбда, играющего доминирующую роль в защите легочной ткани.
- Имеет несколько механизмов противовирусного и иммуномодулирующего действия.
- Не вызывает «цитокинового шторма».
- Применим в комплексной терапии бактериальных, хламидийных, микоплазменных и грибковых заболеваний.
- Максимальная активность уже через 4 часа после приема (максимум продукции интерферона определяется через 4–24 часа в последовательности «кишечник — печенка — кровь»).
Исследования:
- АМИКСИН® IC клинически изучен.
- Опубликовано более 470 научно-исследовательских работ, в которых экспериментально и клинически подтверждено противовирусное действие активного вещества препарата — тилорона. Почти два десятка клинических испытаний и более 39 тысяч пациентов-участников.
- Профилактический курс приема АМИКСИНА® IC в период эпидемического и сезонного подъема простудных заболеваний снижает заболеваемость ОРВИ в 3,4 раза.
![]() Татьяна Давыдова, кандидат медицинских наук, врач иммунолог, старший научный сотрудник лаборатории и клинического отдела молекулярной иммунофармакологии ГУ «Институт микробиологии и иммунологии им. И. И. Мечникова Национальной медицинской академии наук Украины»
Татьяна Давыдова, кандидат медицинских наук, врач иммунолог, старший научный сотрудник лаборатории и клинического отдела молекулярной иммунофармакологии ГУ «Институт микробиологии и иммунологии им. И. И. Мечникова Национальной медицинской академии наук Украины»
Список литературы:
- Furuyama W, Marzi A. Ebola virus: pathogenesis and countermeasure development. Annu Rev Virol. 2019;6(1):435–58. CAS Article Google Scholar
- Sean Ekins, Thomas R. Lane, Peter B. Madrid. Tilorone: a Broad-Spectrum Antiviral Invented in the USA and Commercialized in Russia and beyond. Springer Link. Pharm Res 2020;37:71 CAS Article Google Scholar
- Musso D, Ko AI, Baud D. Zika virus infection — after the pandemic. N Engl J Med. 2019;381(15):1444–57. Article Google Scholar
- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, Shi Z, Hu Z, Zhong W, Xiao G. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res 2020.
- Holshue ML, DeBolt C, Lindquist S, Lofy KH, Wiesman J, Bruce H, Spitters C, Ericson K, Wilkerson S, Tural A, Diaz G, Cohn A, Fox L, Patel A, Gerber SI, Kim L, Tong S, Lu X, Lindstrom S, Pallansch MA, Weldon WC, Biggs HM, Uyeki TM, Pillai SK, Washington State -nCo VCIT. First Case of 2019 Novel Coronavirus in the United States N Engl J Med 2020.
- CDC. Influenza (flu). Available from: www.cdc.gov/flu/about/burden/index.html.
- CDC. AIDS and HIV. Available from: www.cdc.gov/nchs/fastats/aids-hiv.htm.
- CDC. Hepatitis B. Available from: www.cdc.gov/nchs/fastats/hepatitis.htm.
- Fleming RW, Wenstrup DL, Andrews ER. Bis-basic ethers and thioethers of fluorenone, fluorenol and fluorene. In: US3592819A, editor.: Aventis Inc; 12/30/1968.
- Zhang J, Yao Q, Liu Z. An effective synthesis method for Tilorone Dihydrochloride with obvious IFN-alpha inducing activity. Molecules. 2015;20(12):21458–63. CAS Article Google Scholar
- Selkova EP, Iakovlev VN, Semenenko TA, Filatov NN, Gotvianskaia TP, Danilina GA, Pantiukhova TN, Nikitina G, Tur’ianov M. [Evaluation of amyxin effect in prophylaxis of acute respiratory viral infections]. Zhurnal mikrobiologii, epidemiologii, i immunobiologii. 2001(3):42–46.
- Anon. Amixin. Available from: https://rupharma.com/amixin/.
- Krueger RE, Mayer GD. Tilorone hydrochloride: an orally active antiviral agent. Science. 1970;169(3951):1213–4. CAS Article Google Scholar
- Katz E, Margalith E, Winer B. The effect of tilorone hydrochloride on the growth of several animal viruses in tissue cultures. The Journal of general virology. 1976;31(1):125–9. CAS Article Google Scholar
- Katz E, Margalith E, Winer B. Inhibition of herpesvirus deoxyribonucleic acid and protein synthesis by tilorone hydrochloride. Antimicrob Agents Chemother. 1976;9(1):189–95. CAS Article Google Scholar
- Ratan RR, Siddiq A, Aminova L, Langley B, McConoughey S, Karpisheva K, et al. Small molecule activation of adaptive gene expression: tilorone or its analogs are novel potent activators of hypoxia inducible factor-1 that provide prophylaxis against stroke and spinal cord injury. Ann N Y Acad Sci. 2008;1147:383–94. CAS Article Google Scholar
- Loginova S, Koval’chuk AV, Borisevich SV, Syromiatnikova SI, Borisevich GV, Pashchenko Iu I, et al. Antiviral activity of an interferon inducer amixin in experimental West Nile fever. Vopr Virusol. 2004;49(2):8–11. CAS PubMed Google Scholar
- Harrington DG, Lupton HW, Crabbs CL, Bolt LE, Cole FE, Jr., Hilmas DE. Adjuvant effects of tilorone hydrochloride (analog 11,567) with inactivated Venezuelan equine encephalomyelitis virus vaccine. Proceedings of the Society for Experimental Biology and Medicine Society for Experimental Biology and Medicine (New York, NY). 1981;166(2):257–262.
- Shen L, Niu J, Wang C, Huang B, Wang W, Zhu N, Deng Y, Wang H, Ye F, Cen S, Tan W. High-Throughput Screening and Identification of Potent Broad-Spectrum Inhibitors of Coronaviruses. J Virol. 2019;93(12).
- Karpov AV, Zholobak NM, Spivak NY, Rybalko SL, Antonenko SV, Krivokhatskaya LD. Virus-inhibitory effect of a yeast RNA-tilorone molecular complex in cell cultures. Acta Virol. 2001;45(3):181–4. CAS PubMed Google Scholar
- Madrid PB, Chopra S, Manger ID, Gilfillan L, Keepers TR, Shurtleff AC, et al. A systematic screen of FDA-approved drugs for inhibitors of biological threat agents. PLoS One. 2013;8(4):e60579. CAS Article Google Scholar
- Gaforio JJ, Ortega E, Algarra I, Serrano MJ. Alvarez de Cienfuegos G. NK cells mediate increase of phagocytic activity but not of proinflammatory cytokine (interleukin-6 [IL-6], tumor necrosis factor alpha, and IL-12) production elicited in splenic macrophages by tilorone treatment of mice during acute systemic candidiasis. Clin Diagn Lab Immunol. 2002;9(6):1282–94. CAS PubMed PubMed Central Google Scholar
- Liu Q, Zhou YH, Yang ZQ. The cytokine storm of severe influenza and development of immunomodulatory therapy. Cell Mol Immunol. 2016;13(1):3–10.
- Zholobak NM, Kavok NS, Bogorad-Kobelska OS, Borovoy IA, Malyukina MY, Spivak MY. Effect of tilorone and its analogues on the change of mitochondrial potential of rat hepatocytes. Fiziolohichnyi zhurnal (Kiev, Ukraine: 1994). 2012;58(2):39–43.
- Dutta M, Robertson SJ, Okumura A, Scott DP, Chang J, Weiss JM, et al. A systems approach reveals MAVS signaling in myeloid cells as critical for resistance to Ebola virus in murine models of infection. Cell Rep. 2017;18(3):816–29. CAS Article Google Scholar
- Martin RE, Marchetti RV, Cowan AI, Howitt SM, Broer S, Kirk K. Chloroquine transport via the malaria parasite’s chloroquine resistance transporter. Science. 2009;325(5948):1680–2.
- Lullmann-Rauch R, Pods R, Von Witzendorff B. Tilorone-induced lysosomal storage of sulphated glycosaminoglycans can be separated from tiloroneinduced enhancement of lysosomal enzyme secretion. Biochem Pharmacol. 1995;49(9):1223–33. CAS Article Google Scholar
- Salata C, Calistri A, Parolin C, Baritussio A, Palu G. Antiviral activity of cationic amphiphilic drugs. Expert Rev Anti-Infect Ther. 2017;15(5):483–92. CAS Article Google Scholar
- Garcia-Serradilla M, Risco C, Pacheco B. Drug repurposing for new, efficient, broad spectrum antivirals. Virus Res. 2019;264:22–31. CAS Article Google Scholar
- Andersen PI, Krpina K, Ianevski A, Shtaida N, Jo E, Yang J, Koit S, Tenson T, Hukkanen V, Anthonsen MW, Bjoras M, Evander M, Windisch MP, Zusinaite E, Kainov DE. Novel Antiviral Activities of Obatoclax, Emetine, Niclosamide, Brequinar, and Homoharringtonine. Viruses. 2019;11(10).
- Mazzon M, Ortega-Prieto AM, Imrie D, Luft C, Hess L, Czieso S, Grove J, Skelton JK, Farleigh L, Bugert JJ, Wright E, Temperton N, Angell R, Oxenford S, Jacobs M, Ketteler R, Dorner M, Marsh M. Identification of Broad-Spectrum Antiviral Compounds by Targeting Viral Entry. Viruses. 2019;11(2).
- Pecheur EI, Borisevich V, Halfmann P, Morrey JD, Smee DF, Prichard M, et al. The synthetic antiviral drug Arbidol inhibits globally prevalent pathogenic viruses. J Virol. 2016;90(6):3086–92. CAS Article Google Scholar
- Karpenko I, Deev S, Kiselev O, Charushin V, Rusinov V, Ulomsky E, et al. Antiviral properties, metabolism, and pharmacokinetics of a novel azolo-1,2,4- triazine-derived inhibitor of influenza a and B virus replication. Antimicrob Agents Chemother. 2010;54(5):2017–22. CAS Article Google Scholar
- Kramer MJ, Cleeland R, Grunberg E. Antiviral activity of 10-carboxymethyl-9-acridanone. Antimicrob Agents Chemother. 1976;9(2):233–8. CAS Article Google Scholar
- Tazulakhova EB, Parshina OV, Guseva TS, Ershov FI. Russian experience in screening, analysis, and clinical application of novel interferon inducers. J Interf Cytokine Res. 2001;21(2):65–73. CAS Article Google Scholar
- Semenenko TA, Selkova EP, Nikitina GY, Gotvyanskaya TP, Yudina TI, Amaryan MP, et al. Immunomodulators in the prevention of acute respiratory viral infections. Russ J Immunol. 2002;7(2):105–14. CAS PubMed Google Scholar
- Kuehne RW, Pannier WL, Stephen EL. Evaluation of various analogues of tilorone hydrochloride against Venezuelan equine encephalitis virus in mice. Antimicrob Agents Chemother. 1977;11(1):92–7. CAS Article Google Scholar
- Kaufman HE, Centifanto YM, Ellison ED, Brown DC. Tilorone hydrochloride: human toxicity and interferon stimulation. Proc Soc Exp Biol Med. 1971;137(1):357–60. CAS Article Google Scholar
- Mayer GD, Krueger RF. Tilorone hydrochloride: mode of action. Science. 1970;169(3951):1214–5. CAS Article Google Scholar
- Gupta DK, Gieselmann V, Hasilik A, von Figura K. Tilorone acts as a lysosomotropic agent in fibroblasts. Hoppe Seylers Z Physiol Chem. 1984;365(8):859–66. CAS Article Google Scholar
- Kell AM, Gale M, Jr. RIG-I in RNA virus recognition. Virology. 2015;479– 480:110–121. CAS Article Google Scholar
- Sel’kova EP, Iakovlev VN, Semenenko TA, Filatov NN, Gotvianskaia TP, Danilina GA, Pantiukhova TN, Nikitina G, Tur’ianov M. [Evaluation of amyxin effect in prophylaxis of acute respiratory viral infections]. Zh Mikrobiol Epidemiol Immunobiol. 2001(3):42–46.
- Sel’kova EP, Semenenko TA, Nosik NN, Iudina TI, Amarian MP, Lavrukhina LA, Pantiukhova TN, Tarasova G. [Effect of amyxin--a domestic analog of tilorone--on characteristics of interferon and immune status of man]. Zh Mikrobiol Epidemiol Immunobiol. 2001(4):31–35.
- Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell. 2010;140(6):805–20. CAS Article Google Scholar
- Madrid PB, Panchal RG, Warren TK, Shurtleff AC, Endsley AN, Green CE, et al. Evaluation of Ebola virus inhibitors for drug repurposing. ACS Infect Dis. 2015;1(7):317–26.CAS Article Google Scholar
- Ekins S, Freundlich JS, Clark AM, Anantpadma M, Davey RA, Madrid P. Machine learning models identify molecules active against the Ebola virus in vitro. F1000Res. 2015;4:1091.
- Lane TR, Massey C, Comer JE, Anantpadma M, Freundlich JS, Davey RA, et al. Repurposing the antimalarial pyronaridine tetraphosphate to protect against Ebola virus infection. PLoS Negl Trop Dis. 2019;13(11):e0007890. Article Google Scholar
- Lane TR, Massey C, Comer JE, Freiberg AN, Zhou H, Dyall J, Holbrook MR, Anantpadma M, Davey RA, Madrid PB, Ekins S. Efficacy of Oral Pyronaridine Tetraphosphate and Favipiravir Against Ebola Virus Infection in Guinea Pig Submitted. 2020.
- Ekins S, Madrid PB. Tilorone: A broad-spectrum antiviral for emerging viruses. Antimicrobial Agents Chemother, In press. 2020 Preprint. https://doi. org/10.1101/2020.03.09.984856
- Selkova EP, Tur’ianov MC, Pantiukhova TN, Nikitina GI, Semenenko TA. Evaluation of amixine reactivity and efficacy for prophylaxis of acute respiratory tract infections. Antibiot Khimioter. 2001;46(10):14–8. CAS PubMed Google Scholar
- Chizhov NP, Smol’skaia TT, Baichenko PI, Luk’ianova RI, Teslenko VM, Bavra GP, et al. Clinical research on the tolerance for and the interferon-inducing activity of amiksin. Vopr Virusol. 1990;35(5):411–4. CAS PubMed Google Scholar
- Zakirov IG. Use of amixin in the therapy and prevention of some viral infections. Klin Med (Mosk). 2002;80(12):54–6. CAS Google Scholar
- Anantpadma M, Lane T, Zorn KM, Lingerfelt MA, Clark AM, Freundlich JS, et al. Ebola virus Bayesian machine learning models enable new in vitro leads. ACS Omega. 2019;4(1):2353–61. CAS Article Google Scholar
- Ekins S, Lingerfelt MA, Comer JE, Freiberg AN, Mirsalis JC, O’Loughlin K, Harutyunyan A, McFarlane C, Green CE, Madrid PB. Efficacy of Tilorone Dihydrochloride against Ebola Virus Infection. Antimicrob Agents Chemother. 2018;62(2). CAS Article Google Scholar
- Sangeun Jeon, Meehyun Ko, Jihye Lee, Inhee Choi, Soo Young Byun, Soonju Park, David Shum, Seungtaek Kim. Identification of antiviral drug candidates against SARS-CoV-2 from FDA-approved drugs. 2020
- Shen L, Niu J, Wang C, Huang B, Wang W, Zhu N, Deng Y, Wang H, Ye F, Cen S, Tan W. 2019. High-throughput screening and identification of potent broadspectrum inhibitors of coronaviruses. J Virol. 2019.
 03-мар-2026
03-мар-2026
