Переваги препарату ЦЕТРИЛЕВ у лікуванні алергічних синдромів
Розробка антигістамінних препаратів в середині минулого сторіччя здійснила прорив у лікуванні алергії.
За це неабияке досягнення була присуджена Нобелівська премія з фізіології та медицини. Застосування антигістамінних препаратів при алергії не втратило своєї актуальності навіть сьогодні в умовах бурхливого розширення асортименту медикаментів, однак останнім часом з’явилися нові, ефективніші і безпечніші ліки проти алергії. Прикладом антигістамінного препарату нового покоління є левоцетиризин (ЦЕТРИЛЕВ), який володіє низкою унікальних властивостей, що можуть вивести лікування алергії на ефективніший, якісніший рівень. Перш ніж розглянути переваги застосування препарату ЦЕТРИЛЕВ, слід звернутися до основ сучасного вчення про алергію, які дозволять краще зрозуміти наведений матеріал з препарату.
Як відомо, наразі загальновизнаною є класифікація імунопатологічних реакцій за Джеллом і Кумбсом, згідно з якою розрізняють 4 основні типи імунопатології у людей:
 Слід розуміти, що всі чинники імунної системи, задіяні при реалізації атопічної реакції, самі по собі не є абсолютно шкідливими, а навпаки, виконують в організмі важливі біологічні функції. Не виключенням є прозапальний медіатор гістамін, без якого не можна уявити нормальну фізіологію організму людини. Справді, гістамін виконує багато корисних біологічних функцій, важливих для адаптації, серед яких слід виділити наступні:
Слід розуміти, що всі чинники імунної системи, задіяні при реалізації атопічної реакції, самі по собі не є абсолютно шкідливими, а навпаки, виконують в організмі важливі біологічні функції. Не виключенням є прозапальний медіатор гістамін, без якого не можна уявити нормальну фізіологію організму людини. Справді, гістамін виконує багато корисних біологічних функцій, важливих для адаптації, серед яких слід виділити наступні:
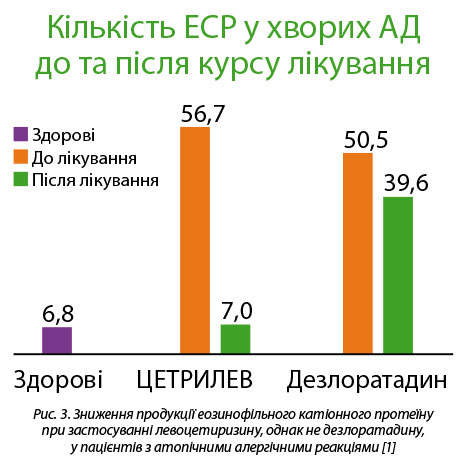 Таким чином, особливістю левоцетиризину, що відрізняє його від антигістамінних препаратів ІІІ покоління, є вплив не тільки на першу, ранню фазу атопічної реакції, однак і пригнічення пізньої, клітинної реакції, що забезпечує виразніший протизапальний та протинабряковий ефекти препарату. Зокрема, в нещодавньому дослідженні показано, що левоцетиризин (ЦЕТРИЛЕВ) виразно пригнічує вироблення еозинофільного катіонного білку (ЕСР) під час алергії, що є наслідком супресивного впливу препарату на еозинофіли – основні фігуранти пізньої фази атопічної реакції. Такими властивостями не володів дезлоратадин, з яким порівнювали протиалергічні ефекти левоцетиризину (рис. 3) [1]. Відповідно до цього, Каней А. (Kanei A.) зі співавторами встановили, що левоцетиризин пригнічує продукцію еозинофільних хемоатрактантів RANTES і еотаксину, що поглибило уявлення про вплив препарату на пізню фазу атопії [5]. В контрольованому клінічному дослідженні, проведеному Уманець Т. Р. зі співавторами, продемонстровано виразну ефективність левоцетиризину (ЦЕТРИЛЕВ) при лікуванні атопічного риніту, поєднаного з бронхіальною астмою, у дітей. Підкреслено сильний протинабряковий ефект препарату щодо слизової оболонки носової порожнини і носоглотки [3]. Наразі реалізується інше контрольоване клінічне дослідження, в якому буде вивчено вплив левоцетиризину на активовані алерген-специфічні лімфоцити – другий тип клітин, що беруть участь у пізній фазі атопії.
Таким чином, левоцетиризин (ЦЕТРИЛЕВ) впливає на обидві фази алергічної реакції – ранню і пізню, що забезпечує виразніший і повноцінніший протиалергічний ефект препарату порівняно з антигістамінними препаратами ІІІ покоління. Це забезпечує глибший і триваліший протизапальний і протинабряковий вплив левоцетиризину, ніж у дезлоратадину і подібних антигістамінних препаратів ІІІ покоління, що може бути особливо корисним у лікуванні хронічних алергічних риніту та дерматиту, навіть у разі важких форм хвороби, суттєво зменшуючи потребу у застосуванні топічних і системних глюкокортикостероїдів. З огляду на вищезазначене, не видаються дивними результати останнього подвійного сліпого плацебо-контрольованого рандомізованого клінічного дослідження Барніол С. (Barniol C.) зі співавторами, які свідчать про те, що комбінація левоцетиризину і преднізолону не має переваг перед монотерапією левоцетиризином при важких формах кропив’янки у людей. В іншому подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні [4] Махатме М. С. (Mahatme M. S.) зі співавторами встановили, що комбінація левоцетиризин-монтелукаст має переваги у співвідношенні вартість/ефективність перед комбінацією фексофенадин-монтелукаст при лікування важкого алергічного риніту [7].
Тому наразі левоцетиризин є одним із найефективніших, найперспективніших протиалергічних препаратів в клінічній практиці.
Таким чином, особливістю левоцетиризину, що відрізняє його від антигістамінних препаратів ІІІ покоління, є вплив не тільки на першу, ранню фазу атопічної реакції, однак і пригнічення пізньої, клітинної реакції, що забезпечує виразніший протизапальний та протинабряковий ефекти препарату. Зокрема, в нещодавньому дослідженні показано, що левоцетиризин (ЦЕТРИЛЕВ) виразно пригнічує вироблення еозинофільного катіонного білку (ЕСР) під час алергії, що є наслідком супресивного впливу препарату на еозинофіли – основні фігуранти пізньої фази атопічної реакції. Такими властивостями не володів дезлоратадин, з яким порівнювали протиалергічні ефекти левоцетиризину (рис. 3) [1]. Відповідно до цього, Каней А. (Kanei A.) зі співавторами встановили, що левоцетиризин пригнічує продукцію еозинофільних хемоатрактантів RANTES і еотаксину, що поглибило уявлення про вплив препарату на пізню фазу атопії [5]. В контрольованому клінічному дослідженні, проведеному Уманець Т. Р. зі співавторами, продемонстровано виразну ефективність левоцетиризину (ЦЕТРИЛЕВ) при лікуванні атопічного риніту, поєднаного з бронхіальною астмою, у дітей. Підкреслено сильний протинабряковий ефект препарату щодо слизової оболонки носової порожнини і носоглотки [3]. Наразі реалізується інше контрольоване клінічне дослідження, в якому буде вивчено вплив левоцетиризину на активовані алерген-специфічні лімфоцити – другий тип клітин, що беруть участь у пізній фазі атопії.
Таким чином, левоцетиризин (ЦЕТРИЛЕВ) впливає на обидві фази алергічної реакції – ранню і пізню, що забезпечує виразніший і повноцінніший протиалергічний ефект препарату порівняно з антигістамінними препаратами ІІІ покоління. Це забезпечує глибший і триваліший протизапальний і протинабряковий вплив левоцетиризину, ніж у дезлоратадину і подібних антигістамінних препаратів ІІІ покоління, що може бути особливо корисним у лікуванні хронічних алергічних риніту та дерматиту, навіть у разі важких форм хвороби, суттєво зменшуючи потребу у застосуванні топічних і системних глюкокортикостероїдів. З огляду на вищезазначене, не видаються дивними результати останнього подвійного сліпого плацебо-контрольованого рандомізованого клінічного дослідження Барніол С. (Barniol C.) зі співавторами, які свідчать про те, що комбінація левоцетиризину і преднізолону не має переваг перед монотерапією левоцетиризином при важких формах кропив’янки у людей. В іншому подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні [4] Махатме М. С. (Mahatme M. S.) зі співавторами встановили, що комбінація левоцетиризин-монтелукаст має переваги у співвідношенні вартість/ефективність перед комбінацією фексофенадин-монтелукаст при лікування важкого алергічного риніту [7].
Тому наразі левоцетиризин є одним із найефективніших, найперспективніших протиалергічних препаратів в клінічній практиці.
 Мальцев Д. В., Інститут експериментальної і клінічної медицини НМУ імені О. О. Богомольця
УДК 616.248+616.21100208:615.218
Мальцев Д. В., Інститут експериментальної і клінічної медицини НМУ імені О. О. Богомольця
УДК 616.248+616.21100208:615.218
- атопічні (IgE-залежні);
- цитотоксичні (а, b);
- імунокомплексні;
- клітинні (а, b, c, d) реакції.
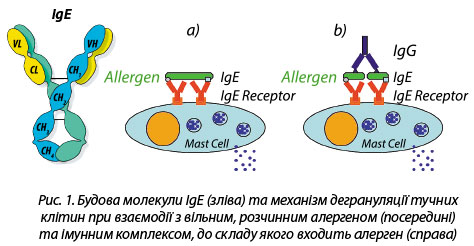
- сенсибілізація, або імунізація до алергену (вироблення специфічних до алергену молекул IgE в ході помилкової імунної відповіді на нешкідливу речовину);
- патохімічний (виділення з активованих тучних клітин медіаторів запалення, включаючи гістамін, які призводять до гіперемії, плазморагії, спазму гладкої мускулатури, гіперкринії тощо);
- патофізіологічний (включає розвиток патофізіологічних феноменів, зокрема – набряку тканин, почервоніння шкіри і слизових оболонок, підвищення локальної температури, свербежу, болю, бронхообструкції тощо);
- клінічний (відбувається поява клінічних симптомів, таких як крапив’янка, набряк Квінке, напад бронхіальної астми тощо).
- Динаміка реалізації атопічної реакції передбачає реалізацію двох послідовних, однак якісно різнорідних за типом запалення і прогностичною значимістю фаз імунопатологічного процесу, які отримали назву ранньої і пізньої.
 Слід розуміти, що всі чинники імунної системи, задіяні при реалізації атопічної реакції, самі по собі не є абсолютно шкідливими, а навпаки, виконують в організмі важливі біологічні функції. Не виключенням є прозапальний медіатор гістамін, без якого не можна уявити нормальну фізіологію організму людини. Справді, гістамін виконує багато корисних біологічних функцій, важливих для адаптації, серед яких слід виділити наступні:
Слід розуміти, що всі чинники імунної системи, задіяні при реалізації атопічної реакції, самі по собі не є абсолютно шкідливими, а навпаки, виконують в організмі важливі біологічні функції. Не виключенням є прозапальний медіатор гістамін, без якого не можна уявити нормальну фізіологію організму людини. Справді, гістамін виконує багато корисних біологічних функцій, важливих для адаптації, серед яких слід виділити наступні:
- активація симпато-адреналової системи;
- вплив на секреторну активність шлунку;
- регуляція всмоктування поживних речовин в кишечнику;
- регуляція сну і бодьорості;
- вплив на терморегуляцію;
- вплив на синтез пролактину, вазопрессину, АКТГ і гормонів кори наднирників;
- регуляція реакції шкіри на пошкодження;
- підтримання оптимальної мікроциркуляції в легенях;
- забезпечення адекватного рівня легеневої вентиляції;
- регуляторний вплив на процеси кровотворення і активність імунонокомпетентних клітин.
- 1 тип, Н1 (гладкі м’язи судин та бронхів);
- 2 тип, Н2 (парієтальні клітини шлунка);
- 3 тип, Н3 (клітини серця і головного мозку);
- 4 тип, Н4 (клітини крові та червоного кісткового мозку) [1].
- перше (діазолін, супрастин, перитол та інші);
- друге (лоратадин, цетиризин, терфенадин та інші);
- третє (фексофенадин, дезлоратадин, левоцетиризин) [2].
- седативний ефект (Н3-рецетори головного мозку);
- негативна інотропна дія (Н3-рецептори серця);
- пригнічення кровотворення, імуносупресивний вплив (Н4-рецетори кісткового мозку і лімфоцитів);
- атропіноподібний ефект, антиадренергічний, серотонінолітічний вплив;
- короткий час дії (1,5–3 години);
- швидке звикання (на 10–12 день прийому).
- швидке настання ефекту, вже через 10–15 хвилин після прийому таблетки (натще);
- тривалий терапевтичний вплив (більше 1 доби);
- відсутність звикання та синдрому віддачі;
- виражений протинабряковий ефект в носоглотці;
- діє на обидві фази алергічної реакції – ранню і пізню;
- добра переносимість в зв’язку з безпрецедентною специфічністю до Н1;
- препарат може застосовуватися тривало без накопичення в організмі і збільшення кількості небажаних ефектів;
- прийом таблеток левоцетиризину дозволений з 6 років, але сама молекула левоцетиризину може призначатися у дітей з самого раннього віку (суспензія).
 Таким чином, особливістю левоцетиризину, що відрізняє його від антигістамінних препаратів ІІІ покоління, є вплив не тільки на першу, ранню фазу атопічної реакції, однак і пригнічення пізньої, клітинної реакції, що забезпечує виразніший протизапальний та протинабряковий ефекти препарату. Зокрема, в нещодавньому дослідженні показано, що левоцетиризин (ЦЕТРИЛЕВ) виразно пригнічує вироблення еозинофільного катіонного білку (ЕСР) під час алергії, що є наслідком супресивного впливу препарату на еозинофіли – основні фігуранти пізньої фази атопічної реакції. Такими властивостями не володів дезлоратадин, з яким порівнювали протиалергічні ефекти левоцетиризину (рис. 3) [1]. Відповідно до цього, Каней А. (Kanei A.) зі співавторами встановили, що левоцетиризин пригнічує продукцію еозинофільних хемоатрактантів RANTES і еотаксину, що поглибило уявлення про вплив препарату на пізню фазу атопії [5]. В контрольованому клінічному дослідженні, проведеному Уманець Т. Р. зі співавторами, продемонстровано виразну ефективність левоцетиризину (ЦЕТРИЛЕВ) при лікуванні атопічного риніту, поєднаного з бронхіальною астмою, у дітей. Підкреслено сильний протинабряковий ефект препарату щодо слизової оболонки носової порожнини і носоглотки [3]. Наразі реалізується інше контрольоване клінічне дослідження, в якому буде вивчено вплив левоцетиризину на активовані алерген-специфічні лімфоцити – другий тип клітин, що беруть участь у пізній фазі атопії.
Таким чином, левоцетиризин (ЦЕТРИЛЕВ) впливає на обидві фази алергічної реакції – ранню і пізню, що забезпечує виразніший і повноцінніший протиалергічний ефект препарату порівняно з антигістамінними препаратами ІІІ покоління. Це забезпечує глибший і триваліший протизапальний і протинабряковий вплив левоцетиризину, ніж у дезлоратадину і подібних антигістамінних препаратів ІІІ покоління, що може бути особливо корисним у лікуванні хронічних алергічних риніту та дерматиту, навіть у разі важких форм хвороби, суттєво зменшуючи потребу у застосуванні топічних і системних глюкокортикостероїдів. З огляду на вищезазначене, не видаються дивними результати останнього подвійного сліпого плацебо-контрольованого рандомізованого клінічного дослідження Барніол С. (Barniol C.) зі співавторами, які свідчать про те, що комбінація левоцетиризину і преднізолону не має переваг перед монотерапією левоцетиризином при важких формах кропив’янки у людей. В іншому подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні [4] Махатме М. С. (Mahatme M. S.) зі співавторами встановили, що комбінація левоцетиризин-монтелукаст має переваги у співвідношенні вартість/ефективність перед комбінацією фексофенадин-монтелукаст при лікування важкого алергічного риніту [7].
Тому наразі левоцетиризин є одним із найефективніших, найперспективніших протиалергічних препаратів в клінічній практиці.
Таким чином, особливістю левоцетиризину, що відрізняє його від антигістамінних препаратів ІІІ покоління, є вплив не тільки на першу, ранню фазу атопічної реакції, однак і пригнічення пізньої, клітинної реакції, що забезпечує виразніший протизапальний та протинабряковий ефекти препарату. Зокрема, в нещодавньому дослідженні показано, що левоцетиризин (ЦЕТРИЛЕВ) виразно пригнічує вироблення еозинофільного катіонного білку (ЕСР) під час алергії, що є наслідком супресивного впливу препарату на еозинофіли – основні фігуранти пізньої фази атопічної реакції. Такими властивостями не володів дезлоратадин, з яким порівнювали протиалергічні ефекти левоцетиризину (рис. 3) [1]. Відповідно до цього, Каней А. (Kanei A.) зі співавторами встановили, що левоцетиризин пригнічує продукцію еозинофільних хемоатрактантів RANTES і еотаксину, що поглибило уявлення про вплив препарату на пізню фазу атопії [5]. В контрольованому клінічному дослідженні, проведеному Уманець Т. Р. зі співавторами, продемонстровано виразну ефективність левоцетиризину (ЦЕТРИЛЕВ) при лікуванні атопічного риніту, поєднаного з бронхіальною астмою, у дітей. Підкреслено сильний протинабряковий ефект препарату щодо слизової оболонки носової порожнини і носоглотки [3]. Наразі реалізується інше контрольоване клінічне дослідження, в якому буде вивчено вплив левоцетиризину на активовані алерген-специфічні лімфоцити – другий тип клітин, що беруть участь у пізній фазі атопії.
Таким чином, левоцетиризин (ЦЕТРИЛЕВ) впливає на обидві фази алергічної реакції – ранню і пізню, що забезпечує виразніший і повноцінніший протиалергічний ефект препарату порівняно з антигістамінними препаратами ІІІ покоління. Це забезпечує глибший і триваліший протизапальний і протинабряковий вплив левоцетиризину, ніж у дезлоратадину і подібних антигістамінних препаратів ІІІ покоління, що може бути особливо корисним у лікуванні хронічних алергічних риніту та дерматиту, навіть у разі важких форм хвороби, суттєво зменшуючи потребу у застосуванні топічних і системних глюкокортикостероїдів. З огляду на вищезазначене, не видаються дивними результати останнього подвійного сліпого плацебо-контрольованого рандомізованого клінічного дослідження Барніол С. (Barniol C.) зі співавторами, які свідчать про те, що комбінація левоцетиризину і преднізолону не має переваг перед монотерапією левоцетиризином при важких формах кропив’янки у людей. В іншому подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні [4] Махатме М. С. (Mahatme M. S.) зі співавторами встановили, що комбінація левоцетиризин-монтелукаст має переваги у співвідношенні вартість/ефективність перед комбінацією фексофенадин-монтелукаст при лікування важкого алергічного риніту [7].
Тому наразі левоцетиризин є одним із найефективніших, найперспективніших протиалергічних препаратів в клінічній практиці.
 04-мар-2026
04-мар-2026