ДЕКСТЕМП – безпечне та ефективне лікування різних видів болю
Найбільші наукові відкриття — результат копіткого спостереження за дрібними фактами
Андре Жид, французький письменник
За статистичними даними, близько 20 % населення планети страждає від болю, щороку діагностують 10 % нових пацієнтів із хронічним болем. За даними Європейської федерації з болю (European Pain Federation), тільки у країнах Європи хронічний біль є причиною втрати 500 мільйонів годин робочого часу на рік. Підраховано, що біль приносить країнам Європи економічні збитки на суму понад 300 мільярдів євро (або 1,5–3 % від валового національного продукту). Третина населення планети, які страждають від хронічного болю, не отримують лікування.
Починаючи із появи першого синтетичного представника класу нестероїдних протизапальних засобів (НПЗЗ) — ацетилсаліцилової кислоти — потреба у створенні ефективних знеболювальних засобів, які б поєднували у собі терапевтичну ефективність і безпеку пацієнтів, не втрачає своєї актуальності.
У третьому тисячолітті до нових лікарських засобів висуваються особливо жорсткі вимоги. Створення ліків на основі абсолютно нових молекул потребує тривалих клінічних досліджень, оскільки при хронічних захворюваннях ліки необхідно приймати тривалий час, що вимагає більш ретельної перевірки щодо відсутності відкладених побічних ефектів. У середньому створення нової молекули — активного фармацевтичного інгредієнту — триває близько 11,8 років і включає розробку, доклінічні і клінічні дослідження, отримання схвалення регуляторними органами. Середня вартість розробки нового лікарського засобу постійно зростає: у 1976 р. вона становила 137 млн доларів США, у 2000 р. — 802 млн, а в кінці 2014 р. — вже 2,56 млрд. При цьому понад три чверті нових молекул, ефективність яких була доведена, не отримують схвалення до застосування і не виходять на фармацевтичний ринок [6].
Використання оптичних ізомерів є основою для розробки нових лікарських засобів
Через високу вартість і тривалість пошуку і розробки нових активних фармацевтичних інгредієнтів провідні фармацевтичні компанії звернули увагу на можливість удосконалення вже добре відомих, традиційних молекул за рахунок використання їх оптичних ізомерів [1].
Існування право- і лівообертальних речовин серед органічних сполук відкрив французький вчений Ж.Б. Біо у 1815 р. Він встановив, що деякі органічні речовини (які отримали назву оптично активних) здатні обертати площину поляризації світла [3].
Обов’язковою умовою оптичної активності речовин є хіральність (від грецьк. cheir — рука) — властивість молекули не суміщатися із власним дзеркальним відображенням. Такі молекули, які мають протилежний кут хіральності, або протилежну конфігурацію, називають хіральними енантіомерами.
При цьому один із енантіомерів обертає площину поляризації світла направо, а інший — наліво. Право- і лівообертальний енантіомери однієї й тієї ж речовини мають однаковий склад і послідовність атомів у молекулі, але відрізняються відносним розташуванням атомів і функціональних груп у просторі, тобто конфігурацією. Вони схожі і відрізняються один від одного, як права і ліва рука людини, які є дзеркальними відображеннями одна одної, але не повторюють одна одну (рис. 1).
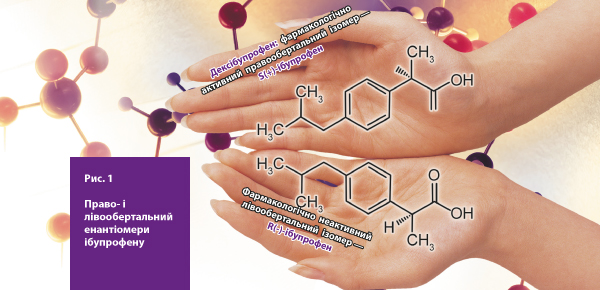
Енантіомери мають однакові фізичні і хімічні властивості (температуру плавлення, розчинність, електропровідність та інші), але по-різному взаємодіють із іншими хіральними сполуками клітин організму, що пояснює відмінності у їх фізіологічній дії [3].
Встановлено, що всі амінокислоти і більшість сахарів є хіральними сполуками. При цьому їх лівообертальні форми не мають смаку і запаху, а правообертальні форми мають солодкий смак. Це пояснюється тим, що білки смакових і нюхових рецепторів організму людини також є хіральними [15].
Переважна більшість сучасних лікарських речовин є оптично неактивною (рацемічною) сумішшю право- і лівообертальних енантіомерів. Саме така суміш утворюється у результаті хімічних реакцій при синтезі лікарських речовин in vitro. Під час біологічних процесів синтезу у живих організмах, навпаки, створюються переважно право- або лівообертальні форми молекул.
Сучасні технології дозволяють поліпшувати біологічну дію активних фармацевтичних інгредієнтів (як за терапевтичною ефективністю, так і за безпекою) за рахунок розділення рацемічної суміші на право- і лівообертальні речовини і отримання оптично чистих енантіомерів.
Для цього можна застосовувати такі методи:
- Механічний метод. При кристалізації деяких оптично активних речовин можуть утворюватися дві форми кристалів, які схожі один на одного, як предмет і його дзеркальне відображення. Їх можна відділити під мікроскопом препаративною голкою. Скориставшись цим методом, Луї Пастер у XIX ст. за допомогою пінцета розділив «праві» і «ліві» кристали тартрату алюмінату натрію.
- Біохімічний метод. Ґрунтується на тому, що певні види мікроорганізмів надають перевагу одній із енантіомерних форм речовини і «з’їдають» її, інша форма залишається незайманою і її можна легко відділити.
- Хімічний метод (стереоселективний синтез). Оснований на використанні оптично активних реагентів і отриманні діастереомерів, які відрізняються один від одного за фізичними властивостями (наприклад, розчинністю у воді), що дозволяє їх розділити [1].
У результаті розділення рацемічної суміші на право- і лівообертальну можуть бути отримані енантіомери, які мають кращу біологічну активність, викликають менше побічних ефектів, мають інші шляхи метаболізму в організмі тощо [20]. Це пов’язано з тим, що лівообертальні стереоізомери краще інтегруються у лівообертальні протеїнові системи живих організмів, а правообертальні — у ліпідні і нуклеотидні [4].
З історії хімії, медицини і фармації відомо багато прикладів, які демонструють важливість вибору «правильного» енантіомеру для створення лікарського препарату.
 Зображення, розміщене на обкладинці американського журналу «Journal of Chemical Education» у 1996 р., наглядно показує, що іноді «дзеркальний» антипод корисної молекули лікарської речовини може виявитися чудовиськом [3] (рис. 2).
Зображення, розміщене на обкладинці американського журналу «Journal of Chemical Education» у 1996 р., наглядно показує, що іноді «дзеркальний» антипод корисної молекули лікарської речовини може виявитися чудовиськом [3] (рис. 2).
Трагічним свідоцтвом цьому стала історія застосування Талідоміду, який на початку 60-х років минулого століття призначався вагітним як снодійний і заспокійливий засіб. У той час, як лівообертальні (S-форми) препарату володіли транквілізуючою дією, правообертальні (D-форми) спричиняли тератогенну дію. Застосування рацемічної суміші Талідоміду у вагітних призвело до трагічних наслідків: тисячі дітей народилися із важкими вадами розвитку [3].
Прикладом того, що один із оптичних ізомерів є набагато ефективнішим за інший, є антибіотик широкого спектру дії левоміцетин — лівообертальний енантіомер. Його бактерицидна активність у 50 разів перевищує активність правообертальної форми (правоміцетину). Це можна пояснити тим, що левоміцетин більш ефективно взаємодіє із протеїнами бактерій, які (як і протеїни людського організму) є хіральними лівообертальними молекулами.
Лівообертальні дофамін і ацетилкарнітин також проявляють більшу ефективність порівняно із правообертальними енантіомерами.
Однак, у знеболювальних і протизапальних лікарських засобів спостерігається протилежна закономірність: правообертальні ізомери проявляють кращу знеболювальну активність, ніж лівообертальні.
Наприклад, лівообертальний енантіомер кетопрофену (R-кетопрофен) позбавлений знеболювальної і протизапальної активності, при цьому він досить токсичний, підвищує ризик шлунково-кишкових ускладнень. На відміну від нього, правообертальний S-кетопрофен є потужним анальгетиком із високою протизапальною активністю і меншою токсичністю [1].
Дексібупрофен — представник нового покоління НПЗЗ
Попередником дексібупрофену є ібупрофен, який з 1962 р. і по теперішній час використовується як знеболювальний засіб.
З точки зору оптичної ізомерії, ібупрофен є рацемічною сумішшю, яка містить приблизно однакову кількість лівообертального ізомеру R(-)-ібупрофену і право-
обертального — S(+)-ібупрофену. Найбільш ймовірною побічною реакцією при його застосуванні є гастротоксична дія.
Енантіомери ібупрофену суттєво відрізняються один від одного за фармакологічними властивостями. Саме S(+)-ібупрофен (дексібупрофен) є фармакологічно активним і здатен інгібувати ЦОГ у фармакологічно значимих концентраціях. R(-)-ібупрофен проявляє фармакологічну активність лише після трансформації у дексібупрофен, яка відбувається у печінці [8].
Енантіомери ібупрофену мають виражені фармакокінетичні відмінності і шляхи метаболізму [18]. Так, S(+)-ібупрофен має кращу біодоступність. R(-)-ібупрофен бере участь у метаболізмі ліпідів і тригліцеридів поряд з ендогенними жирними кислотами. Це може призвести до появи токсичних гібридних тригліцеридів, які депонуються у жировій тканині, утворюючи резервуари, із яких повільно вивільняються і тривало циркулюють в організмі). S (+)-ібупрофен розглядається як більш «чистий» ізомер, який не бере участі у цих метаболічних реакціях ліпідів і тригліцеридів [8].
Дексібупрофен — оптично чистий правообертальний ізомер ібупрофену — з’явився на світовому фармацевтичному ринку у 1992–1993 рр., що можна вважати еволюційним проривом у терапії больового синдрому.
У доклінічних і клінічних дослідженнях показано, що дексібупрофен, як і рацемічний ібупрофен, має протизапальні, аналгетичні і жарознижуючі властивості. Додатково до цих ефектів, він проявляє антиагрегантну дію, порівняну із дією ацетилсаліцилової кислоти.
Переваги дексібупрофену
 Переваги дексібупрофену перед рацемічним ібупрофеном показані у низці досліджень за участю здорових добровольців. Так, у дослідженні G. Geisslinger з співавт. показано, що ефективна концентрація активного ізомеру ібупрофену у плазмі крові при прийомі препарату, що містить чистий S(+)-ібупрофен, досягається протягом коротшого періоду, ніж при прийомі рацемічного препарату, що містить ідентичну кількість S(+)-ізомеру [10].
Переваги дексібупрофену перед рацемічним ібупрофеном показані у низці досліджень за участю здорових добровольців. Так, у дослідженні G. Geisslinger з співавт. показано, що ефективна концентрація активного ізомеру ібупрофену у плазмі крові при прийомі препарату, що містить чистий S(+)-ібупрофен, досягається протягом коротшого періоду, ніж при прийомі рацемічного препарату, що містить ідентичну кількість S(+)-ізомеру [10].
Час, коли пацієнт починає відчувати знеболюючу дію при введенні чистого S(+)-ізомеру ібупрофену, настає раніше, ніж при введенні рацемічного препарату ібупрофену [7].
Схожі результати отримані A. M. Evans з співавт. при порівняльному вивченні фармакокінетики дексібупрофену і рацемічної суміші ізомерів ібупрофену [8].
В іншому дослідженні проведено порівняння біологічної доступності дексібупрофену монопрепарату і як частини рацемату ібупрофену [9]. Здорові добровольці приймали перорально таблетки дексібупрофену по 200, 400 і 600 мг, або рацемату ібупрофену по 400, 800 і 1200 мг. Дослідження показало, що відносна біодоступність дексібупрофену із рацемату ібупрофену склала 0,66. Ці дані є підставою для застосування чистого дексібупрофену у нижчих дозах, ніж рацемату ібупрофену.
Отже, перевагами дексібупрофену перед ібупрофеном є швидше настання знеболювальної дії і можливість застосування у нижчих дозах.
Докази клінічної ефективності дексібупрофену
У численних рандомізованих клінічних дослідженнях показана висока клінічна ефективність і добра переносимість дексібупрофену у пацієнтів із запальними і дегенеративними захворюваннями, зубним болем, головним болем, при гонартрозі, остеоартриті, ревматоїдному артриті, дисменореї [11, 17].
При артритах дексібупрофен у дозі 800 мг надавав такий же аналгезуючий ефект, як 200 мг целекоксибу, а 1200 мг дексібупрофену усував больовий синдром так само, як 2400 мг ібупрофену, при цьому дексібупрофен демонстрував кращу переносимість [2].
Є також дані щодо ефективності дексібупрофену для усунення гострого післяопераційного больового синдрому [5].
У клінічному дослідженні за участі 178 стаціонарних хворих із остеоартритом стегна порівнювали дексібупрофен і рацемічний ібупрофен, як критерій ефективності використовували покращення індексу WOMAC, який характеризує вираженість болю, скованість і функціональну здатність. Установлена еквівалентність дексібупрофену у дозі 400 мг три рази на добу рацемічному ібупрофеному у дозі 800 мг три рази на добу [19].
За результатами рандомізованого подвійного сліпого дослідження за участі 102 амбулаторних хворих із гострим вісцеральним болем внаслідок первинної дисменореї, дексібупрофен забезпечував дозозалежну ефективну анальгезію. Ефект препарату був еквівалентний дії ібупрофену, що використовувався в удвічі більшій дозі [13].
При зубному болю дія 200 мг дексібупрофену еквівалентна або навіть перевершує дію 400 мг рацемічного ібупрофену [2].
Отже, активний енантіомер дексібупрофен при різних станах, що супроводжуються помірним болем, проявляє однакову ефективність порівняно із удвічі більшою дозою рацемічного ібупрофену.
Дані щодо застосування дексібупрофену у пацієнтів із ревматоїдним артритом, анкілозивним спондилітом, остеоартритом колінного і тазостегнового суглобів, болем у спині, дисменореєю узагальнені у клінічному огляді W. Phleps. Показана висока клінічна ефективність і гарна переносимість дексібупрофену при зазначених станах [16].
Безпечність застосування дексібупрофену
Дослідження переносимості дексібупрофену у 223 пацієнтів із остеоартритом показало частоту клінічних несприятливих подій на рівні 15,2 % після 1 року безперервного застосування, що свідчить про гарну переносимість препарату [14].
Ці дані узгоджуються із результатами ще декількох клінічних і 5-річних постмаркетингових досліджень із загальною кількістю 4836 пацієнтів. Показано, що тільки у 3,7 % пацієнтів розвивалися побічні реакції, серед яких серйозні побічні ефекти склали всього 0,06 % [12].
У багатоцентровому дослідженні за участі 489 пацієнтів, які страждають на артроз стегна або коліна, досліджувалася безпека і переносимість дексібупрофену порівняно із ібупрофеном. Дослідження показало кращий профіль безпеки дексібупрофену у дозі 400 мг (добова доза 800 мг) порівняно з ібупрофеном у дозі 400 мг (добова доза 1600 мг). Побічні ефекти з боку шлунково-кишкового тракту спостерігались у 8 пацієнтів (3,3 %) із групи дексибупрофену та у 19 пацієнтів (7,8 %) із групи ібупрофену [21].
Отримані дані дозволяють стверджувати, що поряд із високою клінічною ефективністю дексібупрофен володіє прийнятним профілем безпеки. Це пояснюється особливостями фармакодинаміки і фармакокінетики дексібупрофену — чистого активного енантіомеру ібупрофену.
Декстемп — новий вітчизняний лікарський засіб, що містить дексібупрофен
Поява на ринку нового вітчизняного лікарського засобу ДЕКСТЕМП виробництва АТ «Київський вітамінний завод» суттєво розширить можливості лікарів і пацієнтів у боротьбі із болем.
ДЕКСТЕМП містить покращений активний фармацевтичний інгредієнт групи НПЗЗ — дексібупрофен — активний ізомер рацемічного ібупрофену. Він застосовується для симптоматичного лікування болю слабкої і помірної інтенсивності різного походження: зубного болю, болю у спині, суглобах, м’язах, ревматичного болю, дисменореї.
ДЕКСТЕМП випускається у таблетках по 200 і 400 мг, що дозволяє зручно дозувати препарат залежно від індивідуальних особливостей пацієнта, вираженості і локалізації болю.
ДЕКСТЕМП рекомендований для симптоматичного лікування різних видів болю у дорослих пацієнтів:
- болю і запалення при остеоартриті чи артрозі;
- менструального болю (первинна дисменорея);
- легкого або помірного болю (біль в опорно-руховому апараті, головний біль, зубний біль, хворобливий набряк та запалення після травми);
- для короткочасного симптоматичного лікування ревматоїдного артриту.
Лікарський засіб ДЕКСТЕМП можна рекомендувати широкому колу пацієнтів, зважаючи на оптимальне співвідношення ефективності і безпеки його активного фармацевтичного інгредієнта — дексібупрофену.


Список літератури:
- Баринов А.Н., Махинов К.А., Щербоносова Т.А. Эволюция лекарственных препаратов сквозь призму креационизма // Эффективная фармакотерапия. — 2016. — № 36. — С. 6–12.
- Бездетко Н.В., Мищенко О.Я. Лекарство в зеркале: рассматриваем дексибупрофен // Участковый врач. — 2016. — №9. — С. 36–41.
- Леенсон И.Я. Левое или правое? // Химия и жизнь. — 2009. — №5. — C. 44–45.
- Ariens E. J. et al Stereoselectivity of bioactive agents: general aspects. Int. J. Ad. Pharm. Gen. Res. 2013. № 1 (1). Р. 1–19.
- Derry S. Et al. Single dose oral dexibuprofen [S(+)-ibuprofen] for acute postoperative pain in adults. The Cochrane database of systematic reviews. 2013 (10), CD007550. https://doi.org/10.1002/14651858.CD007550.pub3.
- DiMasi J.A. et al. The cost of drug development. N. Engl. J. Med. 2015. Vol. 372. № 20. P. 1972.
- Dionne R. A. et al. Enhanced analgesia and suppression of plasma beta-endorphin by the S(+)-isomer of ibuprofen. Clin. Pharmacol. Ther. 1998. Vol. 63 (6). Р. 694–701.
- Evans A. M. Comparative pharmacology of S(+)-ibuprofen and (RS)-ibuprofen. Clin Rheumatol. 2001. Vol. 20. Suppl. 1. P. 9–14.
- Gabard B. et al. Comparison of the bioavailability of dexibuprofen administered alone or as part of racemic ibuprofen. European journal of clinical pharmacology. 1995. Т. 48. № 6. P. 505–511.
- Geisslinger G. et al. Pharmacokinetics of S(+)- and R(-)-ibuprofen in volunteers and first clinical experience of S(+)-ibuprofen in rheumatoid arthritis. Eur J Clin Pharmacol. 1990; 38(5): 493-497.
- Hawel R. et al. Double-blind comparative study of the effectiveness and tolerance of 900 mg dexibuprofen and 150 mg diclofenac sodium in patients with painful gonarthrosis. Wiener klinische Wochenschrift. 1997. Т. 109. № 2. С. 53–59.
- Kaehler S.T. et al. Dexibuprofen: pharmacology, therapeutic uses and safety. Inflammopharmacology. 2003. Т. 11. № 4–6. С. 371–383.
- Kollenz C. et al. ADIDAC trial: analgesia with dexibuprofen versus ibuprofen in patients suffering from primary dysmenorrhea: a crossover trial. Gynecol Obstet Invest. 2009. Vol. 67(1). P. 25–31.
- Mayrhofer F. Efficacy and long-term safety of dexibuprofen (S (+) ibuprofen): a short term efficacy study in patients with osteoarthritis of the hip and a 1 year tolerability study in patients with rheumatic disorders. Clin. Rheumatol. 2001. № 20 (1). Р. 22–29.
- Meierhenrich U. J. Amino acids and the asymmetry of life. Berlin, GER: Springer, 2008.
- Phleps W. Overview on Clinical Data of Dexibuprofen. Clinical Rheumatology. 2001. Vol. 20. P. 15–21.
- Rahlfs V. W. et al. Reevaluation of some double-blind, randomized studies of dexibuprofen (Seractil): a state-of-the-art overview. Studies in patients with lumbar vertebral column syndrome, rheumatoid arthritis, distortion of the ankle joint, gonarthrosis, ankylosing spondylitis, and activated coxarthrosis. J. Clin. Pharmacol. 1996. Vol. 36 (12). Р. 33–40.
- Rudy A. C. et al. Stereoselective metabolism of ibuprofen in humans: administration of R-, S-and racemic ibuprofen. Journal of Pharmacology and Experimental Therapeutics. 1991. Т. 259. №. 3. P. 1133–1139.
- Singer F. et al. Evaluation of the efficacy and dose-response relationship of dexibuprofen (S(+)-ibuprofen) in patients with osteoarthritis of the hip and comparison with racemic ibuprofen using the WOMAC osteoarthritis index. Int J Clin Pharmacol Ther. 2000; 38 (1). P. 15–24.
- Sumithira G. et al. Drug chirality & its clinical significance evident, future for the development/separation of single enantiomer drug from racemates — the chiral switch. Int. J. Ad. Pharm. Gen. Res. 2013. № 1 (1). Р. 1–19.
- Zamani O. et al. Comparison of safety, efficacy and tolerability of dexibuprofen and ibuprofen in the treatment of osteoarthritis of the hip or knee. Wien Klin Wochenschr. 2014. Vol. 126 (11–12). P. 368–375.
![]() Світлана Жадько,
Світлана Жадько,
кандидат фармацевтичних наук, НФАУ
 03-мар-2026
03-мар-2026

