Сравнительная оценка способности энтеросорбентов связывать вещества белковой природы
Резюме. Проведена сравнительная оценка сорбционной активности представителей различных классов энтеросорбентов в отношении высокомолекулярных белковых соединений. В качестве маркера эффективности действия сорбентов использован показатель активности сорбции таких белковых веществ, как сывороточный альбумин человека (САЧ) и желатин. Методами термогравиметрии, микроскопии и адсорбции белков в водной среде исследованы образцы энтеросорбентов, наиболее широко представленных на рынке Украины – Атоксил, Смекта, Энтеросгель, активированный уголь. Доказана максимальная сорбционная активность Атоксила при рН, соответствующем среде верхнего отдела тонкого кишечника, в том числе в пересчете на лечебную дозу.
Резюме. Проведена порівняльна оцінка сорбційної активності представників різних класів ентеросорбентів щодо високомолекулярних білкових сполук. В якості маркера ефективності дії сорбентів використаний показник активності сорбції таких білкових речовин, як сироватковий альбумін людини (САЛ) та желатина. Методами термогравіметрії, мікроскопії та адсорбції білків у водному середовищі досліджені зразки ентеросорбентів, найбільш широко представлених на ринку України – Атоксіл, Смекта, Ентеросгель, активоване вугілля. Доведено максимальну сорбційну активність Атоксілу при рН, що відповідає вмісту верхнього відділу тонкого кишечника, у тому числі в перерахунку на лікувальну дозу.
Summary. There was carried out a comparative evaluation of the sorption activity of different classes of entero-sorbents relatively to high molecular weight protein substances. As a marker of the sorbents efficiency action, the sorption activity index of proteins such as human serum albumin (HSA) and gelatin was used. The methods of thermogravimetry, microscopy and protein adsorption in water medium were used to study the samples of the most widely represented enterosorbents in the Ukrainian market, such as: Atoxil, Smecta, Enterosgel, and Activated Charcoal. The maximum sorption activity of Atoxil in terms of the therapeutic dose under the pH, which corresponds to the medium of upper section of the small intestine, was proven.
![]()
В настоящий момент энтеросорбция, как метод выведения из организма чужеродных веществ, попадающих из окружающей среды или образующихся в самом организме в результате патологических процессов, широко используется в медицинской практике. Энтеросорбенты показали свою эффективность в лечении диарейного синдрома, пищевых отравлений, бактериальных инфекций, аллергических реакций и других патологических процессов, сопровождающихся интоксикацией [1, 2].
На фармацевтическом рынке Украины представлены сорбенты различных классов: на основе высокодисперсного диоксида кремния (Атоксил), гидрогеля метилкремниевой кислоты (Энтеросгель), монтмориллонитовой глины (Смекта) и различных форм активированного угля [3, 4]. Представители различных классов энтеросорбентов могут существенно отличаться по своей сорбционной активности и способности связывать молекулы токсинов различной молекулярной массы. С практической точки зрения значительный интерес представляет сравнительное исследование эффективности использования разных классов энтеросорбентов.
Как известно, в основе патогенеза бактериальных инфекций и прочих заболеваний, сопровождающихся интоксикацией, лежит накопление в организме патологических белков, токсинов бактерий либо олигомерных белковых комплексов, являющихся веществами с высокой молекулярной массой. Молекулярная масса (М.м.) типичных белковых токсинов составляет 15–170 кДа. Так, например, М.м. ботулотоксина составляет 150 кДа [5]. Поскольку значительная часть токсинов, накапливающихся и образующихся в желудочно-кишечном тракте, связана с белковыми молекулами или имеет белковое происхождение, представляется необходимым оценить сорбционную активность представителей различных классов энтеросорбентов в отношении высокомолекулярных белковых соединений. В качестве маркера активности сорбентов может служить эффективность сорбции таких белковых веществ, как сывороточный альбумин человека (САЧ) и желатин [1]. Желатин представляет собой белок, являющийся смесью полимергомологов с молекулярной массой, которая соотносится с типичной массой большинства белковых токсинов. В частности, адсорбция желатина введена как параметр оценки качества адсорбентов в фармакопейных методиках.
Материалы и методы
Для исследований брали образцы энтеросорбентов соответствующих серий (табл. 1).
Табл.1.
Действующие вещества, торговые наименования и серии образцов энтеросорбентов, взятых для исследования

В качестве тест-веществ для изучения адсорбции белков использовали: 1) 10 % раствор сывороточного альбумина человека (раствор для инфузий, лекарственное средство); 2) пищевой желатин марки Bloom 200 (Бельгия), серия 1574737. Испытание проводили методом построения изотермы адсорбции согласно Методическим рекомендациям Государственного экспертного центра МЗ Украины [6]. Весовые дозы препаратов были одинаковыми в пересчете на сухой остаток, содержание которого определяли с помощью термического анализа.
Результаты и обсуждение
Термогравиметрические исследования проводили на дериватографе Paulik&Paulik. Скорость нагрева образца составляла 10 град/мин, предельная температура в печи была 1000 °С. Измерения проводились с целью установления количества воды и вспомогательных веществ в образцах. При этом использовали тот факт, что вода из систем с развитой поверхностью, к которым относятся исследуемые образцы, удаляется при температурах Т < 150 °C. При температурах Т < 400 °C происходит газификация большинства органических соединений (сахара, полимеры), применяемые в некоторых энтеросорбентах в качестве вспомогательных веществ. Присоединенные к поверхности кремнийорганических соединений алкильные группы могут разрушаться при температуре до 550 °C. Термограммы исследуемых образцов приведены на рис. 1а-г. В частности, представлены кривые потери массы (ТГ-кривая), а также ДТГ и ДТА-кривые. ДТГ-кривая представляет собой производную dm/dT. Она позволяет более точно определить положение точек перегиба на кривой потери массы, что соответствует процессам, которые происходят в образце при повышении температуры. ДТА-кривая является второй производной от потери массы. С ее помощью можно выявить тип процесса. Так, максимумы на кривой ДТА соответствуют экзотермическим, а минимумы – эндотермическим процессам.
Для препарата диоктаэдрического смектита (рис. 1а) при T < 150 °C масса образца практически не меняется, что свидетельствует о почти полном отсутствии связанной воды. На ДТГ-кривой регистрируются два минимума при 180 и 260 °C. Им соответствуют точки перегиба на кривой потери массы (кривая ТГ). Максимальная потеря массы образца составляет 27 % при 700 °C. В соответствии с инструкцией завода-изготовителя основным веществом является диоктаэдрический смектит (3 г), а вспомогательными веществами служат глюкоза – 0,749 г, сахарин натрия – 0,007 г и ванилин – 0,004 г. Таким образом, потеря массы при нагревании образца происходит за счет разрушения вспомогательных веществ, а их количество соответствует заявленному заводом-изготовителем. Наличие одного широкого максимума на кривой ДТА свидетельствует об экзотермичности процессов деструкции вспомогательных веществ (при нагревании выделяется тепло).
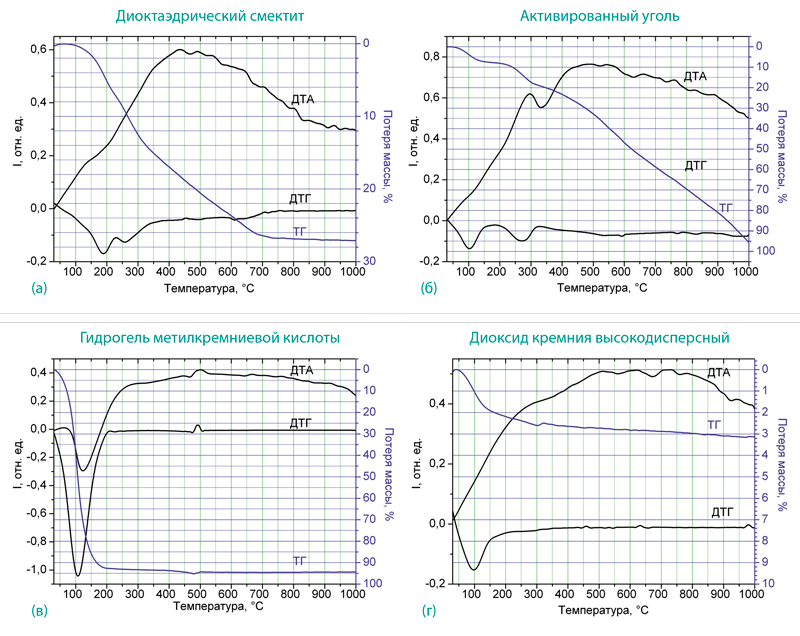
Рис. 1. Термограммы исследуемых сорбентов: диоктаэдрический смектит – (а); активированный уголь – (б); гидрогель метилкремниевой кислоты – (в); диоксид кремния высокодисперсный – (г).
В отличие от диоктаэдрического смектита, при термодеструкции активированного угля происходит газификация всего присутствующего в образце углеродного материала. Зольность образца составляет 9,05 % (рис. 1б). Первый минимум на ДТГ-кривой наблюдается при 100 °C. Он соответствует испарению присутствующей в образце воды, количество которой составляет 7 % от массы. Второй минимум при 280 °C соответствует деструкции полимерных веществ, количество которых в соответствии с кривой ТГ составляет около 12 % массы. Поскольку заводом-изготовителем не указаны вспомогательные вещества, то наиболее вероятным является присутствие полимерной составляющей, используемой для производства таблетированных форм. При 330 °C на кривой ДТА наблюдается эндотермический пик. Он может быть обусловлен перестройкой углеродного скелета полимерных молекул в процессе их карбонизации.
Зольность образца гидрогеля метилкремниевой кислоты (рис. 1в) составляет 6,7 % массы. Это количество сухого остатка, которое образовалось при нагревании полиметилсилоксана. Около 93 % массы образца составляет вода, которая используется заводом-изготовителем для производства гидрогеля и удаляется из препарата при Т < 150 °C. Соответственно на кривой ДТГ регистрируется один минимум при 100 °C. Небольшой эндотермический максимум на кривой ДТА при 500 °C может быть связан с удалением гидроксильных групп из полиметилсилоксановой матрицы, происходящим совместно с деструкцией метильных групп. Таким образом, количество действующего вещества в образце гидрогеля метилкремниевой кислоты не превышает 6–7 % массы.
Термограмма образца высокодисперсного диоксида кремния приведена на рис. 1г. На ней присутствует один минимум на кривой ДТГ при 100 °С, что соответствует потере массы за счет испарения влаги. Исходная влажность образца составляет 3 % массы, что соответствует нормам, заложенным в Фармакопее и согласуется с нормами контроля качества завода-изготовителя. Небольшие экзотермические пики при 500–800 °С, вероятно, соответствуют процессу конденсации силанольних групп.
Сведенные показатели содержания сухого остатка после прокаливания образцов исследуемых сорбентов при 1000 °С представлены в табл. 2.
Табл.2.
Содержание сухого остатка после прокаливания образцов исследуемых сорбентов при 1000 °С

Микрофотографии сорбентов, полученные с помощью микроскопа Primо Star, Zeiss, представлены на рис. 2.

Рис. 2. Микрофотографии сорбентов, полученных с помощью микроскопа Primi Star Ceis, Yena:
диоктаэдрический смектит – (а); активированный уголь – (б); гидрогель метилкремниевой кислоты – (в);
диоксид кремния высокодисперсный – (г).
Исследуемые материалы, за исключением гидрогеля метилкремниевой кислоты, присутствуют в виде частиц, размер которых составляет от единиц до нескольких десятков мкм. Образец гидрогеля метилкремниевой кислоты исследовали в виде водного геля, поскольку его высушивание приводит к полному изменению морфологии и поверхностных характеристик. На поверхности геля наблюдаются оптически неоднородные структуры (рис. 2в), что, вероятно, связано с кристаллизацией геля, самопроизвольным изменением дисперсной среды и выделением жидкой фазы.
При изучении активности сорбции белков к 7-ми навескам каждого из препаратов добавляли по 8 мл растворов САЧ или желатина с возрастающей концентрацией. Для сопоставимости результатов полученные данные по адсорбции для диоктаэдрического смектита, гидрогеля метилкремниевой кислоты и высокодисперсного диоксида кремния рассчитывали на одинаковую массу сухого остатка, определенную методом термического анализа (см. выше). Поскольку активированный уголь при проведении термического анализа полностью газифицируется, массу навески для него рассчитывали, исходя из заявленного заводом-изготовителем состава таблетки (табл. 3).
Табл.3.
Расчет навески препарата, взятой для изучения активности сорбции белков

Для исследования использовали водные растворы САЧ и желатина. Концентрация добавленных к навескам сорбентов растворов (Со) была в диапазоне 0–1 % (0–10 мг/мл) для САЧ и в диапазоне 0–0,8 % (0–8 мг/мл) для желатина. Пробирки с полученными суспензиями встряхивали на аппарате для встряхивания в течение 2 ч, затем центрифугировали при частоте 6000 об/мин в течение 20 мин. К 1 мл каждого центрифугата добавляли 4 мл биуретового реактива, перемешивали и оставляли на 30 мин.
Оптические плотности полученных растворов и раствора сравнения измеряли при длине волны 540 нм против холостого раствора. Для приготовления раствора сравнения к 1 мл стандартного раствора белка добавляли 4 мл биуретового реактива, перемешивали и оставляли на 30 мин. Холостой раствор представлял собой смесь 1 мл воды и 4 мл биуретового реактива. Исходя из линейного характера зависимости оптической плотности от концентрации, находили концентрации белка в центрифугате (равновесные концентрации, Ср). Затем рассчитывали величину адсорбции (А, мг/г) по формуле:
А = (Со – Ср) × 125,
где 125 (коэффициент) = 8 мл среды/0,064 г весовой дозы.
Изотермы адсорбции желатина и САЧ на поверхности высокодисперсного диоксида кремния приведены на рис. 3. Учитывая, что в водной среде значение рН не фиксировано, что может влиять на величину сорбции [1], нами была изучена адсорбция желатина из воды и фосфатного буферного раствора, рН которого 6,86 и присутствие солей в диссоциированной форме (0,05 М) приближают эксперимент к физиологическим условиям (модель верхнего отдела тонкого кишечника). Буферный раствор готовили из стандартной смеси гидрофосфата натрия и фосфата калия по ГОСТ 8.135:2009.

Рис. 3. Изотермы адсорбции желатина из буферного раствора и воды и САЧ из воды на поверхности высокодисперсного диоксида кремния (Атоксила).
Из рис. 3 следует, что полученные изотермы адсорбции ленгмюровского типа [7]. Для высокодисперсного диоксида кремния максимальная адсорбция (Аmax) желатина из буферного раствора достигает 480 мг/г, а из воды лишь 300 мг/г. Эффективность адсорбции САЧ высокодисперсным диоксидом кремния характеризуется величиной Аmax = 100 мг/г. Различие в величинах адсорбции желатина при изменении рН обусловлено тем, что адсорбция белковых молекул контролируется электростатическими взаимодействиями [1,8] и кроме рН зависит также от ионной силы раствора.
Адсорбция белковых молекул на поверхности гидрофильного кремнезема (Атоксила) осуществляется достаточно быстро. На рис. 4 представлена кинетическая кривая адсорбции желатина из воды высокодисперсным диоксидом кремния. Видно, что 70 % имеющегося в растворе белка абсорбируется поверхностью кремнезема в течение первых 10 мин (200 мг/г) взаимодействия. После этого скорость адсорбции замедляется, а на кинетической кривой наблюдается перегиб, который соответствует времени адсорбции 15 мин (250 мг/г). Согласно кинетической кривой, можно заключить, что в течение 30 мин (280 мг/г) высокодисперсный диоксид кремния практически полностью реализует свой адсорбционный потенциал.

Рис. 4. Кинетика адсорбции желатина на поверхности высокодисперсного диоксида кремния (Атоксила) из водного раствора.
Среди прочих исследуемых сорбентов, активированный уголь вовсе не адсорбирует САЧ, что полностью совпадает с результатами предыдущих исследований [9]. Поры угля слишком узкие для проникновения в них белковых веществ и других высокомолекулярных соединений. Адсорбция САЧ диоктаэдрическим смектитом незначительна, полученные в разных опытах показатели адсорбции сосредоточены в диапазоне 40–60 мг/г. Значение максимальной адсорбции САЧ из воды для гидрогеля метилкремниевой кислоты составляет 330 мг/г.
На величину адсорбции желатина значительно влияет обработка водной дисперсии высокодисперсного диоксида кремния ультразвуком. После УЗ-обработки гидрофильного кремнезема в течение 5 мин максимальная величина адсорбции возрастает до 580 мг/г. Это обусловлено тем, что на поверхности кремнезема высвобождается максимальное количество активных силанольных групп, что делает их более доступными для адсорбции белковых молекул.
Адсорбционные характеристики высокодисперсного диоксида кремния в сравнении со значениями максимальной адсорбции, полученными для других адсорбентов, приведены в табл. 4.
Табл. 4.
Максимальная сорбция (Аmax, мг/г) САЧ и желатина исследуемыми препаратами

Для сравнения лечебного эффекта исследуемых энтеросорбентов нами проведен перерасчет величины адсорбции на разовую дозу, указанную в инструкциях по применению препаратов (http://mozdocs.kiev.ua) [10]. Результаты приведены в табл. 5. Как видно, эффективность сорбции в отношении САЧ из водной среды возрастает в ряду диоктаэдрический смектит < гидрогель метилкремниевой кислоты < диоксид кремния высокодисперсный, а в отношении желатина как из воды, так и из буферного раствора возрастает в ряду гидрогель метилкремниевой кислоты < диоктаэдрический смектит < диоксид кремния высокодисперсный.
Табл. 5.
Максимальная сорбция (Аmax, мг/г) исследуемыми препаратами
в пересчете на разовую лечебную дозу

Таким образом, при энтеральном применении в виде готовых лекарственных форм, представленных на фармацевтическом рынке Украины, в отношении сорбции белковых соединений наиболее эффективным можно считать высокодисперсный диоксид кремния.
Выводы:
- Максимальную величину сорбции в отношении белковых молекул высокодисперсный диоксид кремния проявляет при рН, соответствующем среде верхнего отдела тонкого кишечника.
- Скорость адсорбции белков на поверхности высокодисперсного диоксида кремния достаточно высокая. В течение 30 минут Атоксил практически полностью реализует свой адсорбционный потенциал.
- Активированный уголь практически не сорбирует белки, поскольку его структура представлена микропорами, недоступными для проникновения высокомолекулярных соединений.
- В пересчете величины сорбции белка на лечебную дозу высокодисперсный диоксид кремния (Атоксил) существенно превосходит гидрогель метилкремниевой кислоты и диоктаэдрический смектит, что особенно проявляется в случае адсорбции желатина.
![]() И. И. Геращенко, Т. В. Крупская, В. В. Туров
И. И. Геращенко, Т. В. Крупская, В. В. Туров
Институт химии поверхности им. А.А. Чуйко, НАН Украины, Киев, ул. Генерала Наумова, 17
 30-окт-2025
30-окт-2025