ЭРБИСОЛ® УЛЬТРАфарм в лечении персистирующей герпетической инфекции
Персистирующие вирусные инфекции названы ВОЗ одной из ведущих медицинских проблем столетия. И среди них одни из главных объектов внимания — вирусы группы герпеса, способные вызывать иммунопатологические состояния и поражения разных органов и систем, особенно нервных тканей, длительно оставаясь в иммунокомпетентных тканях организма и ускользая от иммунного ответа организма.
В данной работе будут рассмотрены механизмы воздействия герпес-вирусов на функцию иммунной системы и вызываемые на этом фоне некоторые иммунодефицитные состояния, включая синдром хронической усталости и постгерпетическую невралгию. Будут проанализированы некоторые аспекты в подходах к лечению и коррекции иммунной дисфункции и очерчена результативность и целесообразность включения комплексного иммунобиологического препарата ЭРБИСОЛ® УЛЬТРАфарм в схемы лечения пациентов с персистирующей герпетической инфекцией.
Проблеме герпетических инфекций и их патологического воздействия на фоне длительной персистенции придается все большее значение в последние годы [1]. Семейство герпес-вирусов включает в себя три подсемейства: α, β, γ. Выделяют восемь типов вирусов герпеса, способных вызывать разные заболевания у людей. Характерной особенностью инфекций этой группы является способность вирусов находиться в организме человека в состоянии персистенции — функционально активном состоянии в клетках организма за пределами сроков, характерных для острой инфекции [1, 2].
Альфа-герпес-вирусы характеризуются коротким циклом репликации, способностью к эффективному разрушению инфицированных клеток, быстрому распространению по клеточной культуре, элективному разрушению зараженных клеток и способностью существовать в латентной инфекционной стадии в сенсорных ганглиях, а также поражению и персистенции в Т-клетках. В подсемейство входят простые герпесы 1 и 2 типа (ВПГ-1 и 2) и вирус ветряной оспы (ВЗВ) [1–3].
Бета-герпес-вирусы имеют длительный цикл репликации, вызывают возникновение манифестной и персистирующей инфекции в лимфоидной ткани, слюнных железах, почках и других тканях. Гаммагерпес-вирусы инфицируют Ти В-лимфоциты, хотя репродуцируются в основном в В-клетках. Герпесвирусные инфекции, обусловленные лимфотропными вирусами, относятся к подсемействам βи γ-герпесвирусов: цитомегаловирус (ЦМВ), вирус герпеса человека 6-го типа (ВГЧ-6), вирус герпеса человека 7-го типа (ВГЧ-7) и вирус Эпштейна-Барра (ВЭБ), вирус герпеса человека 8-го типа (ВГЧ-8) [1–3].
Вирусная репликация в лимфоцитах приводит к иммуносупрессии, как результату прямого воздействия на функцию лимфоцитов. Герпес-вирусы вызывают деструкцию и повреждение клеточной стенки лимфоцитов, снижение специфических функций лимфоцитов, оказывая прямой эффект на эффекторную и хелперно-супрессорную функцию Т-клеток, а также на способность В-клеток к продукции антител; влияют на продукцию и активацию медиаторов; провоцируют поликлональную активацию В-клеток. Вирусная репликация в макрофагах также приводит к определенной иммуносупрессии в результате их функциональных изменений [2, 3]. Персистенция герпесов вызывает снижение ответа на хемотаксические стимулы, оказывает влияние на формирование лизосом-фагосом, воздействует на антиген-представляющую и антиген-распознающую активность. Иммуносупрессия является результатом воздействия вируса и фонового дисбаланса в иммунной системе с последующей супрессией клеточной регуляции, снижением уровня циркулирующих CD4+/CD8+ и индукции Т-клеток и макрофагов [3, 4].
До сегодняшнего времени сохраняются споры по вопросам патогенеза герпетических инфекций и отношения данного класса вирусных агентов к супрессии иммунной системы. Особенности патогенеза инфекций семейства герпес заключаются в пожизненном сохранении вирусов в организме человека, которые обладают способностью при внедрении вирусной ДНК изменять фенотипические свойства клеток хозяина, приводя к трансформации клеток. В результате трансформации запускаются иммунопатологические реакции, направленные против организма человека и проявляющиеся вирус-индуцированной иммуносупрессией [5].
Вирус-индуцированная иммуносупрессия является многофакторным явлением, основанным на сложных взаимодействиях между макрои микроорганизмом. Представление о том, что инфекция — процесс, полностью зависимый от микроорганизма, доминирует в сознании врачей. Однако часто нарушения в системе иммунитета организма, которые предшествуют ей, игнорируются. Хотя индукция и интенсивность инфекционного процесса зависят от дозы, вирулентности, пути проникновения возбудителя, но также важным является степень недостаточности естественного или приобретенного иммунитета макроорганизма. Именно недостаточность иммунитета — относительный (к данному возбудителю) или абсолютный иммунодефицит — в каждой конкретной ситуации служит определяющим фактором развития инфекции. Инфекция же, в свою очередь, как фактор индукции, способствует реализации инфекционно-индуцированного иммунодефицита [2, 7]. Сочетание этих факторов особенно важно для герпес-индуцированных иммунодефицитов ввиду того, что степень поражения населения для некоторых подвидов герпесвирусов достигает 99 %, этот факт делает сложным установление этиопатогенетических причинно-следственных связей с развитием заболевания. Однако длительность и особенности персистенции герпес-вирусов, их иммунотропность и иммунопатогенность обуславливают наибольшую значимость данных инфекционных агентов в развитии иммунодефицитных состояний [2, 8].
 Синдром хронической усталости (СХУ) также в некоторой мере можно отнести к иммунодефицитному состоянию. Данная патология весьма распространена в настоящее время и не имеет точно установленной природы. Безусловно, в ее развитии играют роль факторы окружающей среды, особенности жизни в современных мегаполисах, неблагоприятная экологическая обстановка, чрезмерные психоэмоциональные нагрузки, гипои авитаминозы, а также другие факторы. Однако одной из ведущих причин СХУ является активность герпес-вирусов. А перечисленные внешние факторы — лишь плодотворная почва для развития вирусного патологического процесса, приводящего к вирус-индуцированной иммуносупрессии [2–4].
Синдром хронической усталости (СХУ) также в некоторой мере можно отнести к иммунодефицитному состоянию. Данная патология весьма распространена в настоящее время и не имеет точно установленной природы. Безусловно, в ее развитии играют роль факторы окружающей среды, особенности жизни в современных мегаполисах, неблагоприятная экологическая обстановка, чрезмерные психоэмоциональные нагрузки, гипои авитаминозы, а также другие факторы. Однако одной из ведущих причин СХУ является активность герпес-вирусов. А перечисленные внешние факторы — лишь плодотворная почва для развития вирусного патологического процесса, приводящего к вирус-индуцированной иммуносупрессии [2–4].
Распространенность СХУ убикваторная, в основном, в цивилизованных странах в среднем болеет 0,02 % населения. Считается, что в США СХУ страдают не менее 4 млн жителей страны, преимущественно женщины. В нашей стране также высок процент встречаемости этого заболевания и составляет около 3,7 % в крупных городах, а состояние высокого риска развития заболевания до 18,5 % [2, 3].
Существует несколько теорий этиологии и патогенеза этого заболевания. Наиболее убедительной в настоящее время является инфекционная, или вирусная, теория возникновения СХУ. Эта теория возникла в связи с тем, что развитие синдрома часто начинается с «гриппозных симптомов». Триггерными факторами СХУ являются вирусы — ВЭБ, ЦМВ, ВГЧ-1, ВГЧ 2, ВГЧ-6 (носящий имя «вируса хронической усталости»), а также некоторые другие вирусные инфекции: вирусы гепатитов, энтеровирусы, реторовирусы, аденовирусы [8, 9].

Убедительными представляются данные о высокой частоте обнаружения персистирующих герпесвирусов
и признаков их реактивации у таких пациентов. Полностью не исключается возможность существования до сих пор не идентифицированного вируса — причинного агента СХУ — по мнению многих ученых, вероятнее всего, из группы герпес-вирусов [1, 4, 10].
Еще одним распространенным проявлением герпес-индуцированного иммунодефицита является постгерпетическая невралгия (ПГН), сопровождающаяся выраженным болевым синдромом и значительным снижением качества жизни пациента. Известно, что заболевание развивается на фоне стрессовых, как психоэмоциональных, так и физиологических состояний, приводящих к резкой иммунной супрессии и сопровождающейся активизацией герпесвирусного процесса в периферической нервной системе и ЦНС. ПГН — один из наиболее распространенных и стойких хронических болевых синдромов в практике невропатолога, часто трудно поддающийся лечению. Причиной ПГН являются, как правило, α-герпес-вирусы (ВПГ1 и ВЗВ), однако фоновая персистенция других видов герпеса может провоцировать и усиливать их активность [2, 11].
ЦЕЛЬ:
Изучение эффективности препарата ЭРБИСОЛ® УЛЬТРАфарм в комплексном лечении персистирующей герпетической инфекции, герпес-индуцированных иммунодефицитов, постгерпетической невралгии и синдрома хронической усталости, изучение влияния препарата на показатели клеточного иммунитета и вирусную нагрузку на фоне проведенного лечения.
ЭРБИСОЛ® УЛЬТРАфарм является препаратом с иммунологическим, противовирусным и регенерирующим механизмом воздействия. Фармакологическая активность препарата основана на действии низкомолекулярных биологически активных пептидов (эмбриональных олиго- и глико-пептидов, нуклеотидов и аминокислот), активизирующих естественные контролирующие системы организма, которые отвечают за поиск и устранение патологических изменений. ЭРБИСОЛ® УЛЬТРАфарм ускоряет восстановление поврежденных тканей за счет уничтожения аномальных клеток. Основной иммуномодулирующий эффект препарата проявляется, прежде всего, благодаря действию на NК-клетки (CD3-/16+56+) и Т-киллеры (CD3+/16+56+), которые отвечают за уничтожение поврежденных клеток, неспособных к регенерации или аномальных клеток (клеток-вирусоносителей) и тканей, а также через макрофагальное звено, ответственное за репарацию поврежденных клеток и восстановление функциональной активности органов и тканей. ЭРБИСОЛ® УЛЬТРАфарм активирует Т-клеточное звено, что важно для обнаружения персистирующей вирусной инфекции и подавления ее репликации, необходимое условие для успешной противовирусной терапии в дополнение к узконаправленным противовирусным препаратам. Также препарат индуцирует синтез α-, bи γ-интерферонов, фактора некроза опухоли, интерлейкина-2 (ИЛ-2) и ИЛ-12, ингибирует синтез ИЛ-10 [12].
Материалы и методы
В рамках научной темы НИР НАМН 142/2018 на базе ГУ «Институт микробиологи и иммунологии им. И.И. Мечникова НАМН Украины» были проведены клинико-иммунологические исследования у 260 пациентов в возрастном диапазоне от 19 до 73 лет (средний возраст 47,3 года). В группу исследования были включены пациенты с синдромом хронической усталости (число пациентов 80), вторичными иммунодефицитами при наличии подтвержденной активности герпес-вирусов (число пациентов 120), постгерпетической невралгией (число пациентов 60). Каждая из нозологических групп пациентов была поделена на 2 равные части, сопоставимые по возрасту и состоянию. Часть пациентов в каждой нозологической форме получала лечение только противовирусными препаратами, вторая часть пациентов получала комплексное этиопатогенетическое лечение с применением препарата ЭРБИСОЛ® УЛЬТРАфарм.
Оценку состояния проводили врач невропатолог и иммунолог. Лабораторные исследования включа ли в себя: иммунологический профиль, этиологические исследования (обнаружение белков ответственных за репликацию вирусов при помощи реакция непрямой иммуннофлуоресценции в PBMC (peripheral blood mononuclear cells, в мононуклеарах периферической крови), сывороточные вирус-специфические антитела IgM и IgG ВПГ-1 и 2, ВЗВ, ВЭБ (ранний антиген EA, вирусный капсидный антиген VCA, ВЭБ ядерный антиген EBNA), ЦМВ, ВГЧ-6) с помощью иммуноферментного анализа (ИФА).
Схемы лечения, которые использовались у пациентов данного исследования, для первой части пациентов включали только противогерпетические препараты: ацикловир по 800 мг 3 раза в день 15 дней (или валацикловир по 1000 мг 3 раза в день 15 дней, в зависимости от вирусной нагрузки), и для второй группы пациентов — ацикловир/валацикловир в тех же дозировках в сочетании с ЭРБИСОЛ УЛЬТРАфарм по 2 мл в/м 2 раза в день 15 дней.
Статистическая обработка материала проводилась при помощи стандартной программы офиса Excel в системе Windows, с использованием автоматизированной системы Statistica. Она включала описание выборки, нахождение средней арифметической, среднеквадратического отклонения и ошибки средней арифметической, определялись частоты встречаемости признаков, группировка данных. Различия между параметрами сравнения считались статистически значимыми при р≤0,05. Для решения задач использованы методы рангового корреляционного анали за по Спирмену, линейного регрессионного анализа. Достоверность различий абсолютных и относительных показателей оценивалась с использованием критериев Манна-Уитни, Крускалла-Уоллеса, «Т» и «Z» Стьюдента. При оценке различий качественных показателей использовался хи-квадрат Пирсона.
Результаты и обсуждение
Стандартом фармакотерапии пациентов с рецидивирующими формами заболеваний, вызванных герпесами, является терапия ациклическими нуклеозидами (ацикловир, валацикловир, фамцикловир). Однако монотерапия противовирусными препаратами зачастую не позволяет добиться контроля над инфекцией. Даже в сочетании с препаратами интерферонов и индукторов интерферонов эффективность противогерпетических препаратов зачастую недостаточна [5, 7]. Способность длительно ускользать от иммунного ответа у герпес-вирусов связана с особенностями их патогенеза. Они способны ингибировать передачу активационного сигнала от рецептора ИФН-α/β к ядру, что приводит к нарушению ответа клеток на ИФН-α и часто обусловливает неэффективность интерферонотерапии. Поверхностные гликопротеины герпес-вирусов ослабляют активацию системы комплемента и лизис инфицированных клеток, связывают Fc-фрагмент IgG и препятствуют антителозависимой противовирусной защите. Антигены вирусов герпеса подобны антигенам кератина человека и рецепторам ацетилхолина, что обеспечивает заметную толерантность к вирусам герпеса. Все типы герпеса инфицируют иммунокомпетентные клетки (лимфоциты, макрофаги, дендритные клетки) и снижают их функциональную активность [1–3].
Одним из механизмов, противостоящих действию защитных факторов вирусного иммунитета, является персистенция последних в тканях, не подлежащих иммунному надзору. Клетки, составляющие строму данных тканей, не экспрессируют на своей поверхности антигены І класса HLA (главного комплекса гистосовместимости человека) и в норме анатомически защищены от интервенции и репродукции вирусов [8–10].
Неэффективность противогерпетического иммунитета обусловлена тем, что вирус в ганглиях и иммунных клетках сохраняется не в виде интактных частиц, а в форме субвирусных структур — ДНК-19 белкового комплекса. О неэффективности гуморального иммунитета свидетельствуют рецидивы герпеса на фоне высоких титров противогерпетических антител. При инфицировании В-лимфоцитов лишь в небольшом количестве клеток вирус реплицируется, а в остальных — находится в латентном состоянии [6, 8]. На ранних этапах возможно инфицирование Ти NK-лимфоцитов с развитием хронической инфекции и персистенцией вируса в лимфоцитах на протяжении всей жизни [8–10].
В нашей стране высок процент встречаемости этого заболевания и составляет около 3,7 % в крупных городах, а состояние высокого риска развития заболевания до 18,5 % [2, 3]
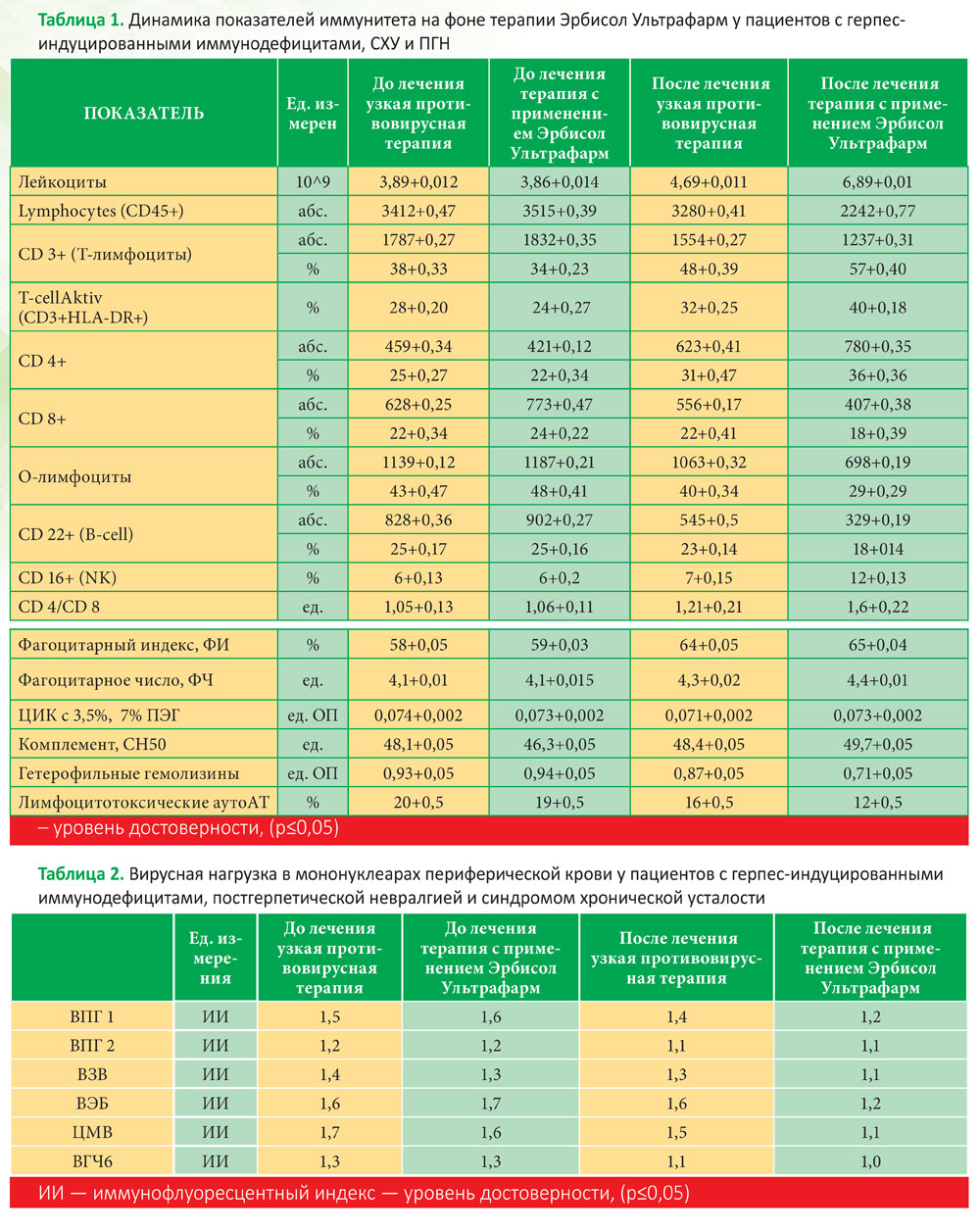
Многочисленные исследования свидетельствуют о возникновении у пациентов с герпес-вирусной инфекцией вторичной иммунной недостаточности, которая чаще всего обусловлена снижением количества клеток иммунной системы или их функциональной недостаточностью либо дисбалансом компонентов системы иммунореактивности [4–9], что было подтверждено также в нашем исследовании (Табл. 1). Были изменения в клеточном звене, выраженные в относи-тельном и абсолютном лимфоцитозе, снижении обще-го количества лейкоцитов до субнормальных показателей (Табл. 1). Данные изменения прослеживались у всех нозологических групп пациентов и с герпес-индуцированными иммунодефицитами, а также с СХУ и ПГН, и были близкими по значениям во всех возрастных группах. Иммунологические изменения также характеризовались снижением до нижней границы нормы количества натуральных киллеров CD 16+ (NK) и в свою очередь повышением CD 22+ (B-cell), 0-лимфоцитов и лимфоцитотоксических аутоантител, гетерофильных гемолизинов. Показатели и соотношение CD 4/CD 8 отклонялось в сторону повышения CD 8+, с признаками цитотоксичности (Табл. 1).
Включение иммунокоррегирующего препарата ЭРБИСОЛ® УЛЬТРАфарм позволило нормализовать соотношение и активность клеточного звена иммунитета, в то время как у пациентов, получавших только противовирусную терапию по окончанию курса лечения отмечались менее выраженные, однако характерные изменения в показателях.
Полиморфноядерные мононуклеары (РВМС) также вовлечены в иммунный ответ при герпетической инфекции и выполняют сдерживающую функцию в распространении вирусов [1, 3]. Поражение РВМС герпес-вирусами нарушает их деятельность и приводит в совокупности с другими факторами к срыву адаптационных реакций [2–5]. Депрессия активности ферментов этих лейкоцитов усугубляет иммунодефицит, а также способствует сохранению активности патологического процесса. Снижение резервных метаболических возможностей РВМС периферической крови в период клинической ремиссии может стать одной из причин рецидивов заболевания.
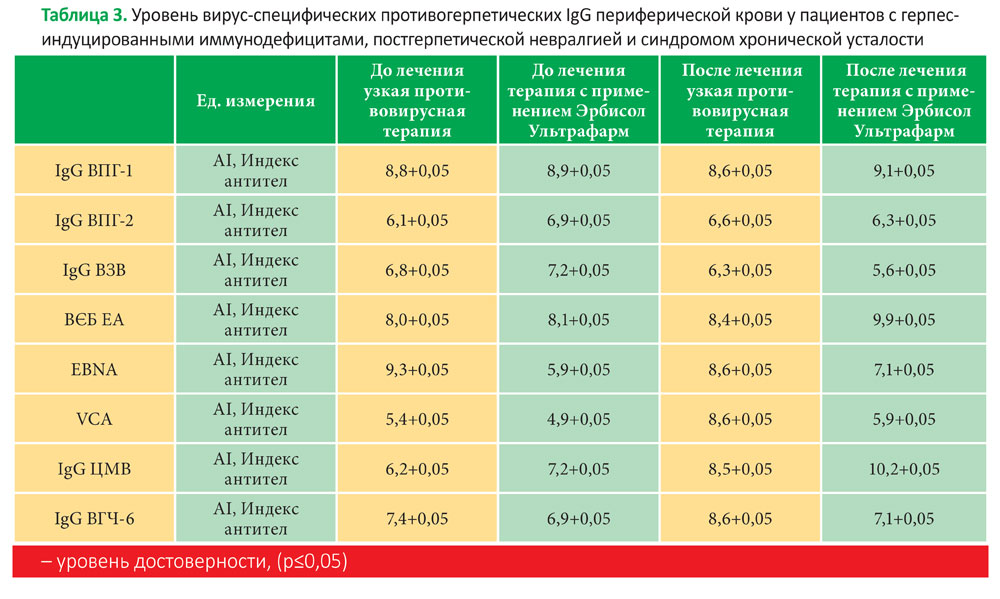
Учитывая патогенез и механизмы персистенции герпес-вирусов, наиболее целесообразным является определение вирусной нагрузки в РВМС для определения интенсивности вирусного процесса и выборатактики ведения пациентов [4, 5]. В нашем исследовании определялась вирусная нагрузка методом непрямой иммунофлуоресценции [4–6]. У всех пациентов, входивших в группы исследования (герпес-индуцированный иммунодефицит, СХУ и ПГН), обнаруживалась вирусная нагрузка, в подавляющем большинстве случаев за счет наличия активности 2-х и более вирусов (Табл. 2): 80,5 % — ВПГ-1, 15 % — ВПГ-2, 74,5 % — ВЗВ, 68 % — ВЭБ, 56 % — ЦМВ, 30 % — ВГЧ-6.
У 78 % пациентов было одновременно активно два и более вирусов герпеса в РВМС, и у 12,5 % одновременно обнаруживались все 6 типов герпеса. В результате применения противовирусных препаратов у первой группы пациентов вирусная нагрузка уменьшилась на 28,6 %, а у группы, получавшей комплексное лечение с применением ЭРБИСОЛ® УЛЬТРАфарм, на 63 %. Для подавления активности герпесов в обоих случаях потребуется продолжение лечения, однако значительная разница в эффективности подчеркивает преимущества комплексного подхода в лечении. ЭРБИСОЛ® УЛЬТРАфарм можно рекомендовать для применения широких группах с различными нозологическими проявлениями герпес-вирусных инфекций. Его репарационные возможности способствуют восстановлению поврежденных тканей, в частности, уменьшению воспалительного процесса в нервной ткани, что значительно улучшает состояние пациентов.
При исследовании вирусспецифических антител к герпесам иммуноглобулинов класса М не было обнаружено ни у одного пациента, участвовавшего в исследовании. Уровни же иммуноглобулинов класса G превышали нормативные показатели от 5,4 до 10,2 раз, в среднем 7,4 раза (Табл. 3).
Несмотря на значительное содержание специфических антител в крови, реактивация герпеса вновь приводит к рецидиву заболевания. Высокое содержание вирус-специфических антител не способно элиминировать вирусную инфекцию [3]. Следовательно, у пациентов с хроническими рецидивирующими герпесвирусными инфекциями имеет место комбинированный вторичный иммунодефицит с нарушением в Ти/ или В-клеточном звене иммунной системы, угнетением функциональной активности NK-лимфоцитов и клеток моноцитарно-макрофагального ряда, а также нарушением системной иммунорегуляции [4]. Поэтому при хронической герпетической инфек ции иммунный ответ оказывается либо количественно и качественно незавершенным, либо недостаточно специфичным. В данной ситуации специфические антитела можно назвать «слепыми свидетелями процесса» и не имеющими особого диагностического значения показателями, так как на фоне проведенного в обеих группах лечения показатели менялись хаотично, что не коррелировало с состоянием, другими иммунологическими показателями и вирусной нагрузкой пациентов, и изменение их показателей не имело достоверного уровня отклонения (Табл. 3).
Все сказанное выше подтверждает тот факт, что иммунные реакции играют существенную роль в развитии, клинических проявлениях и реактивации персистирующей герпетической инфекции. Оценка состояния системы иммунитета в клинической практике важна для прогнозирования течения инфекции и оценки эффективности проводимой противовирусной терапии, а также для обоснования необходимости включения иммунотропных препаратов для комплексной терапии герпес-вирус-индуцированных заболеваний [1–4].
Цитокины, особенно ФНО-α и ИЛ-6, играют важную роль в устранении вируса, а также в поддержании гомеостаза нервной системы посредством репарации и защиты нейронов от повреждений. Потому цитокиновое действие ЭРБИСОЛ® УЛЬТРАфарм является важным в устранении клинических проявлений СХУ и ПГН и в то же время регулируя цитокиновый профиль и корректируя герпес-индуцированный иммунодефицит. Поэтому включение иммунокоррегирующего препарата ЭРБИСОЛ® УЛЬТРАфарм в схемы лечения процессов, связанных с активностью герпес-вирусов, с учетом его влияния на защитные системы организма, является важным и целесообразным.
Выводы
Включение препарата ЭРБИСОЛ® УЛЬТРАфарм в комплексную терапию персистирующей герпетической инфекции, герпес-индуцированных иммунодефицитов, постгерпетической невралгии и синдрома хронической усталости значительно ускоряет нормализацию показателей клеточного звена иммунитета, способствует стимуляции NK (CD3-/16+56+) и Т-киллеров (CD3+/16+56+), способных распознать и уничтожить клетки-вирусоносители. ЭРБИСОЛ® УЛЬТРАфарм помогает активировать Т-клеточное звено, что важно для обнаружения персистирующей вирусной инфекции и подавления ее репликации, необходимое условие для успешной противовирусной терапии в дополнение к узконаправленным противовирусным препаратам. Влияние препарата на Ти В-клетки позволяет нормализовать цитокиновый профиль, стимулируя выработку α-, bи γ-интерферонов, фактора некроза опухоли, противовоспалительных интерлейкина-2 (ИЛ-2) и ИЛ-12, ингибирует синтез ИЛ-10.
Нормализация функционирования иммунного ответа позволяет не только убрать клинические проявления герпес-индуцированных иммунодефицитов, болевой синдром ПГН и симптомы СХУ, но и ограничить возможность репликации вирусов с последующим поражением ими тканей нервной системы и иммунных клеток. Низкомолекулярные пептиды, входящие в состав препарата, позволяют ускорить процессы репарации и регенерации нервных тканей и восстановить нормальное функционирование иммунной системы.
Включение препарата ЭРБИСОЛ® УЛЬТРАфарм является важным и необходимым этапом в решении проблемы персистенции герпес-вирусов и лечении герпесиндуцированных иммунопатологий (синдрома хронической усталости, постгерпетической невралгии и вторичных иммунодефицитов герпетической природы).

Литература:
- Griffiths , Baraniak I., Reeves M. The pathogenesis of human cytomegalovirus. J Pathol. 2015;235:288–297. [PubMed] [Google Scholar]
- Maltsev V. Herpes Virus Neuroinfection Rights: [Monograph]. Kyiv: Center for Educational Literature. 2015. P. 371–445.
- Staikov I, Neykov N, Marinovic B [et al]. Herpes zoster as a systemic disease // Clin 2014 May-Jun; 32(3) P. 424-429.
- Latour S, Winter S. Inherited Immunodeficiencies With High Predisposition to Epstein-Barr Virus-Driven Lymphoproliferative Diseases // Front Immunol. 2018 Jun 4;9. 1103.
- Лобзин С.В., Головкин В.И., Фоминцева М.В. [et al] Вариант герпесассоциированной демиелинизации с синдромом рассеянного склероза // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. – 2015. – Т. 7, № 4. – С. 101–105.
- Taylor GS, Long HM, Brooks JM, [et al]. The immunology of EpsteinBarr virus-induced disease // Annu Rev Immunol (2015) 33. P. 787– 821. [PubMed] [CrossRef] [Google Scholar]
- Munz Epstein-Barr virus-specific immune control by innate lymphocytes // Front Immunol (2017) 8. P. 1658. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Djaoud Z, Guethlein LA, Horowitz A, [et al]. Two alternate strategies for innate immunity to Epstein-Barr virus: one using NK cells and the other NK cells and gammadelta T cells // J Exp Med (2017) P. 1827–1841. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kimura H, Cohen Chronic active Epstein-Barr virus disease // Front Immunol (2017) 8. P. 1867. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fischer A. Recent advances in understanding the pathophysiology of primary T cell immunodeficiencies // Trends Mol Med (2015) 21. 408–416. [PubMed] [CrossRef] [Google Scholar]
- Notarangelo Combined immunodeficiencies with nonfunctional T lymphocytes // Adv Immunol (2014) 121. P. 121–190. [PubMed] [CrossRef] [Google Scholar]
- https://compendium.com.ua/info/169108/erbisol-sup-sup-ul_trafarm/
![]() Татьяна Давыдова, кандидат медицинских наук, врач иммунолог, научный сотрудник лаборатории и клинического отдела молекулярной иммунофармакологии ГУ «Институт микробиологии и иммунологии им. И. И. Мечникова Национальной медицинской академии наук Украины»
Татьяна Давыдова, кандидат медицинских наук, врач иммунолог, научный сотрудник лаборатории и клинического отдела молекулярной иммунофармакологии ГУ «Институт микробиологии и иммунологии им. И. И. Мечникова Национальной медицинской академии наук Украины»
 15-дек-2025
15-дек-2025